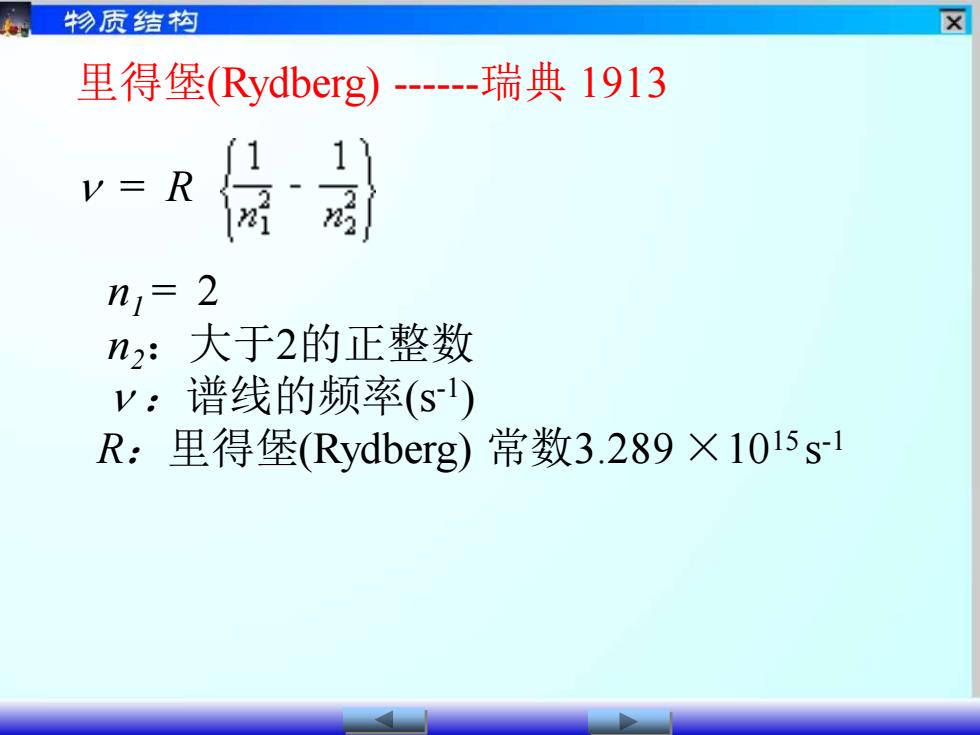
x物质结构里得堡(Rydberg)-----瑞典 1913RV =信动2n,=大于2的正整数n2:谱线的频率(s-1)V:R:里得堡(Rydberg)常数3.289 X1015s-1
里得堡(Rydberg) -瑞典 1913 = R n1 = 2 n2:大于2的正整数 :谱线的频率(s-1 ) R:里得堡(Rydberg) 常数3.289 ×1015 s -1

X物质结构eVTB2、玻尔(Bohr)理论的三个假设Bohr(1)、在原子中电子不能沿着任意轨道绕核旋转,只能在那些符合一定条件的轨道上旋转,而且在此轨道上旋转时,不吸收或放出能量,处于稳定态(基态)
2、玻尔(Bohr)理论的 三个假设 (1)、在原子中电子不能沿着任 意轨道绕核旋转,只能在那些 符合一定条件的轨道上旋转, 而且在此轨道上旋转时,不吸 收或放出能量,处于稳定态 (基态) Bohr

x物质结构电子在不同轨道上旋转时具有不同能(2)、量,电子运动时所处的能量状态称为能级电子的能量是量子化的:Io=ao n?e22元me41En = -=一B一h2h?n?2r2元me4B == 13.6 eV=2.179 X 10-18h2当 n=1 r=52.9pmE=-2.179 X 10-18i
(2)、电子在不同轨道上旋转时具有不同能 量,电子运动时所处的能量状态称为能级。 电子的能量是量子化的: r0=a0 n 2 e 2 2 2me4 1 En = - = - = -B 2r h2n 2 n 2 2 2me4 B = = 13.6 eV=2.179×10-18j h 2 当 n=1 r=52.9pm E=-2.179×10-18j

x物质结构(3)、电子从一个定态跳到另一个定态,才能有能量的吸收或放出。即:hv=Ez-E_ =E光子= hc / αE2 -E;V=hB11/2 =he(mnB= 1.097X 107hc
(3)、电子从一个定态跳到另一个定态, 才能有能量的吸收或放出。即: = E光子 = hc / 1/ = = 1.097×107 h E E v hv E E 2 1 2 1 − = = −
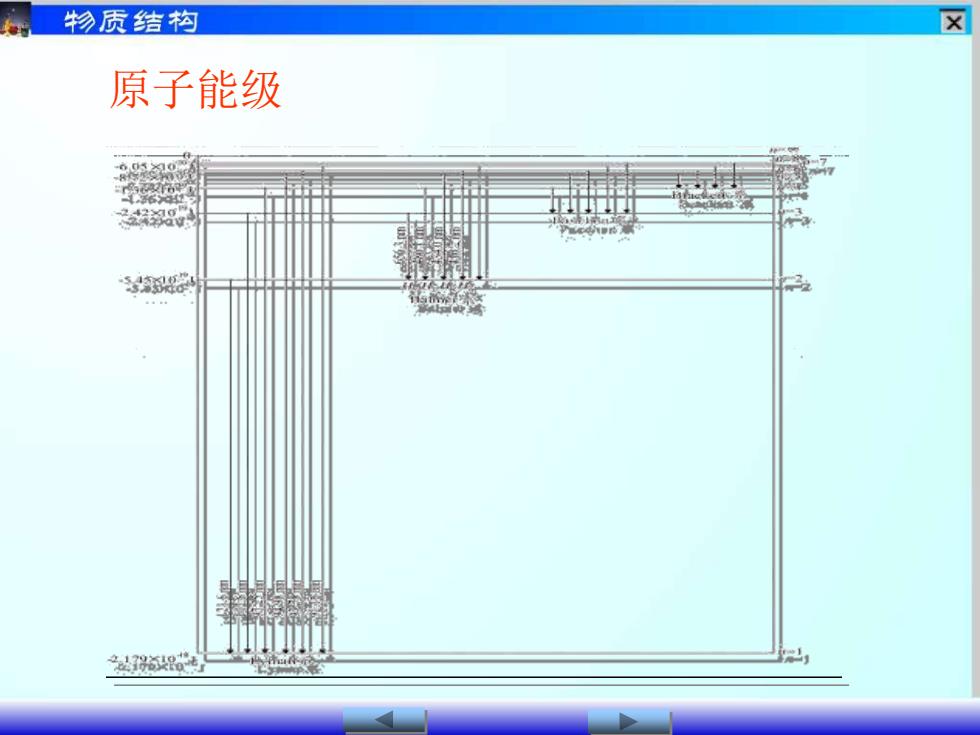
X物质结构原子能级
原子能级