
★ 氢的存在状态 氢的状态 金属氢(S) 液态氢① 固态氢(s) 密度gcm3 0.562 0.071 0.089 3x10%kPa H2(g) (s) 11000K H2(g) .5x10kPaH(s) 77K 金刚石砧 大气层顶 ★木星结构 云层顶 根据先锋飞船探测得知, 瓷志金量 岩石核心 木星大气含氢82%,氨17%, 其它元素<1%
大 气 层 顶 云 层 顶 液 氢 液态金属氢 岩 石 核 心 ★ 木星结构 根据先锋飞船探测得知, 木星大气含氢82%,氦17%, 其它元素<1%. ★ 氢的存在状态 (s) 11000K 3 10 kPa H (g) 8 2 属氢 H(s) 77K 2.5 10 kPa H (g) 8 2 金刚石砧 氢的状态 金属氢(s) 液态氢(l) 固态氢(s) 密度/g·cm-3 0.562 0.071 0.089
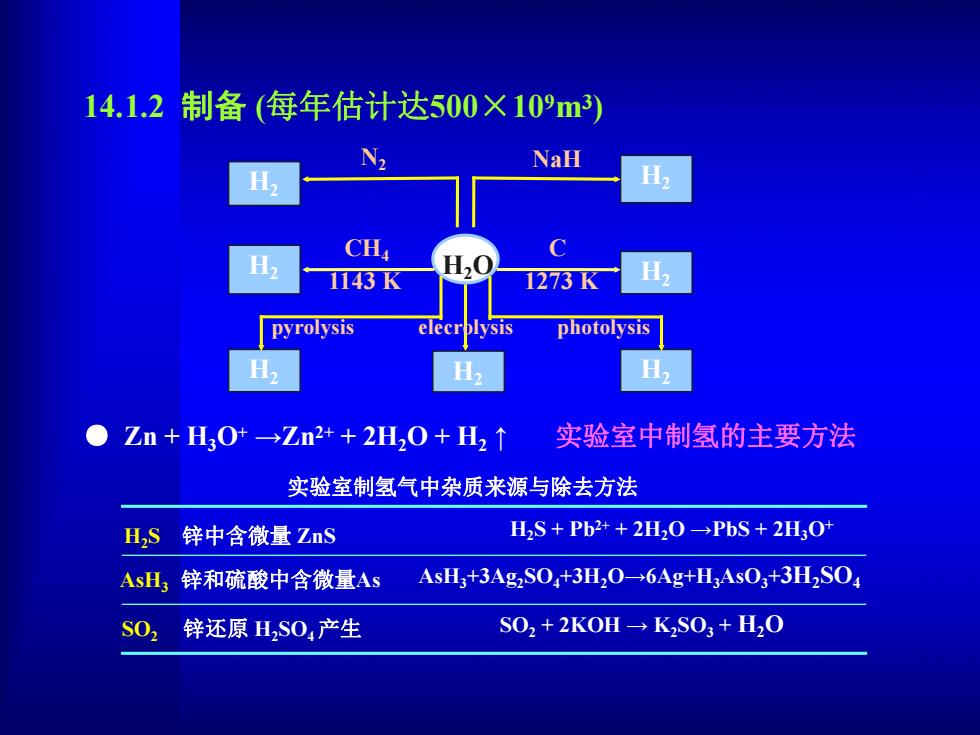
14.1.2制备(每年估计达500×10m3) NaH H H CH 1143K 1273K H, pyrolysis elecrplysis photolysis Zn+H30→Zn2++2H20+H2↑ 实验室中制氢的主要方法 实验室制氢气中杂质来源与除去方法 HS 锌中含微量ZnS H2S+Pb2++2H2O-PbS+2H3O+ AsH3锌和硫酸中含微量As AsH3+3Ag2SO+3H2O-6Ag+H3AsO3+3H2SO S02 锌还原H2S0,产生 S02+2KOH→KS03+H2O
14.1.2 制备 (每年估计达500×109m3) ● Zn + H3O+ →Zn2+ + 2H2O + H2 ↑ 实验室中制氢的主要方法 实验室制氢气中杂质来源与除去方法 H2S + Pb2+ + 2H2O →PbS + 2H3O+ AsH3 锌和硫酸中含微量As AsH3+3Ag2SO4+3H2O→6Ag+H3AsO3+3H2SO4 H2S 锌中含微量 ZnS SO2 锌还原 H2SO4产生 SO2 + 2KOH → K2SO3 + H2O H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis elecrolysis photolysis

当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而 且都是通过与水(最廉价的氢资源)的反应实现的 水蒸气转化法 CH(g)+H2O(g)-1273K3 H2(g)+CO(g) 其中产物氢的三分之一来自水 水煤气反应 C (s)+H2O(g) 1273K H2(g)+CO(g) 其中产物氢的百分之百来自水, H2(g)+COg)就是水煤气,可做工业燃料,使用时不必分离。 但若为了制氢,必须分离出CO. 可将水煤气连同水蒸气一起通过红热的氧化铁催化剂,C0 变成CO2,然后在2×106下用水洗涤C02和H2的混合气体,使 C02溶于水而分离出H2 C0+H2+H,0g)e0 一C02+2H >723K
当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而 且都是通过与水(最廉价的氢资源)的反应实现的. 水蒸气转化法 CH4(g) + H2O(g) 3 H2(g) + CO(g) 1 273 K 其中产物氢的三分之一来自水. 水煤气反应 C (s) + H2O(g) H2(g) + CO(g) 1 273 K 其中产物氢的百分之百来自水. H2(g) + CO(g) 就是水煤气,可做工业燃料,使用时不必分离. 但若为了制氢,必须分离出CO. 可将水煤气连同水蒸气一起通过红热的氧化铁催化剂, CO 变成 CO2 ,然后在 2×106 下用水洗涤 CO2和 H2的混合气体,使 CO2溶于水而分离出 H2 . CO + H2 + H2O(g) CO2 + 2 H2 Fe2O3 > 723 K

用焦炭或天然气与水反应制H2,为什么 都需在高温下进行? 因为这两个反应都是吸热反应: CH(g)+H2O(g) 3H(g)+C0(g),Hm=206.0kJmo1 C(S)+H20(g ,H2(g)+CO(g), ,△Hm=131.3 kJ.mol-1 要反应得以进行,则需供给热量,如添加空气或氧气燃烧: C+02 C029 △Hm=-393.7kJmo1 CH4+202 .C02+2H20, △Hm=-803.3 kJ-mol-1 这样靠“内部燃烧”放热,供焦炭或天然气与水作用所需热量 ,无须从外部供给热量,这是目前工业上最经济的生产氢的方法
Question 1 用焦炭或天然气与水反应制 H2 ,为什么 都需在高温下进行? 因为这两个反应都是吸热反应: CH4(g) + H2O(g) 3 H2(g) + CO(g),ΔHθ m = 206.0 kJ•mol–1 C (s) + H2O(g) H2(g) + CO(g), ΔHθ m = 131.3 kJ•mol–1 要反应得以进行,则需供给热量,如添加空气或氧气燃烧: C + O2 CO2 , ΔHθ m = –393.7 kJ•mol–1 CH4 + 2 O2 CO2 + 2 H2O, ΔHθ m = – 803.3 kJ•mol–1 这样靠“内部燃烧”放热,供焦炭或天然气与水作用所需热量 ,无须从外部供给热量,这是目前工业上最经济的生产氢的方法

● 热化学循环法制H2 2H,O(I)+SO,+I,(s)-298K>H,SO.(aq)+2HI(aq) HS0,(g)7K>H,0g)+S0,(g)+,0,(g 2HI(g)73→H,(g)+12(g) 净反应 H,0g)→H,g)+0.(g 电解20%NaOH或15%KOH水溶液,耗能大,效率也只32% 40H→02+2H,0+4e(阳极) 2H20+2e→20H+H2(阴极) 加热(383一423K加压(1013一3039kPa),效率可提高到90%以上
● 热化学循环法制 H2 O (g) 2 1 H O(g) H (g) 2HI(g) H (g) I (g) O (g) 2 1 H SO (g) H O(g) SO (g) 2H O(l) SO I (s) H SO (aq) 2HI(aq) 2 2 1300K 2 2 2 873K 2 4 2 1073K 2 4 2 4 298K 2 2 2 净反应 加热(383—423K)加压(1013—3039kPa),效率可提高到 90% 以上. ● 电解 20% NaOH或 15% KOH水溶液,耗能大,效率也只 32% 4OH- → O2+2H2O + 4e - (阳极) 2H2O +2e - → 2OH- + H2 (阴极)