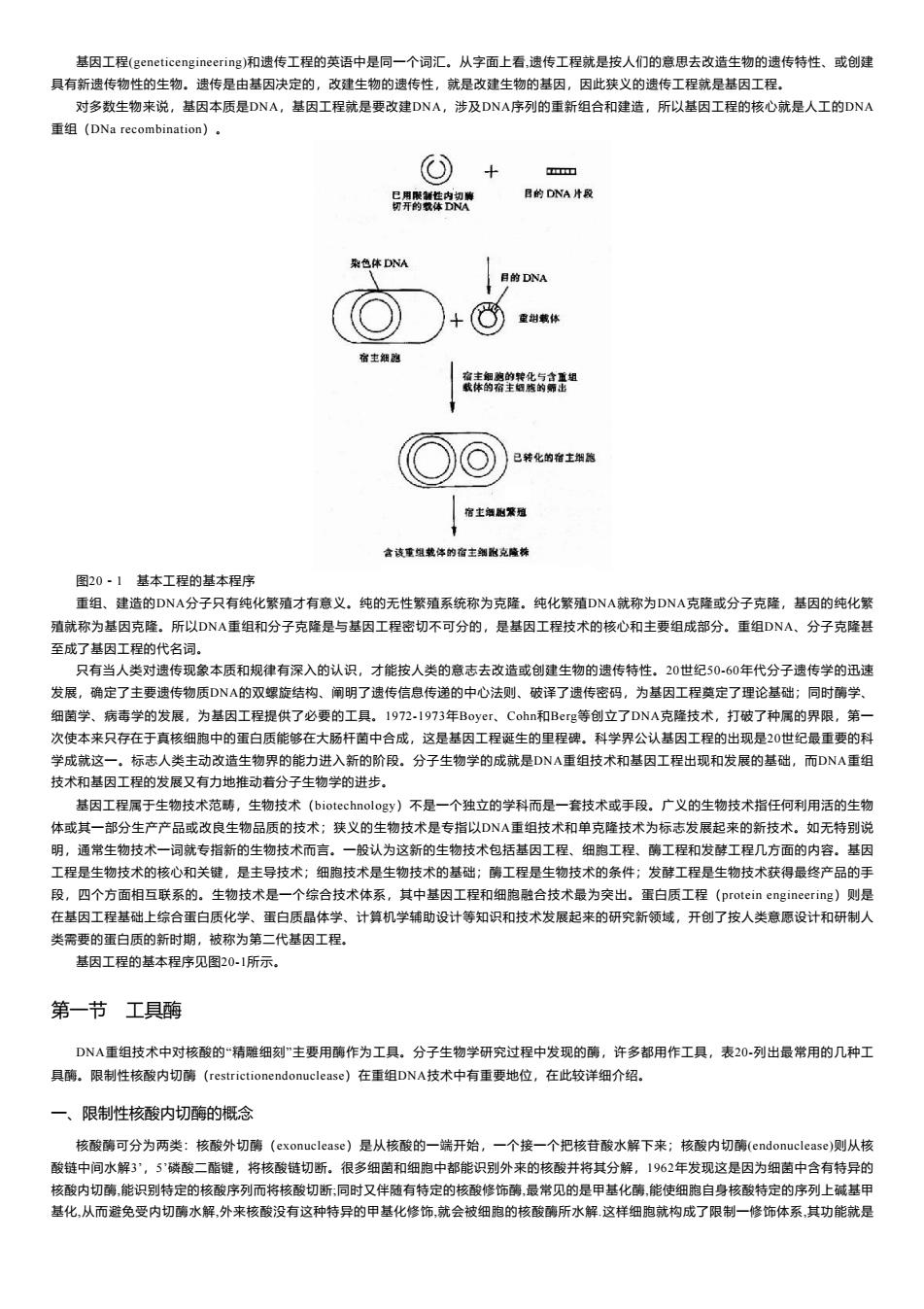
基因工程(geneticengineering)和遗传工程的英语中是同一个词汇。从字面上看,遗传工程就是按人们的意思去改造生物的遗传特性、或创建 具有新遗传物性的生物。遗传是由基因决定的,改建生物的遗传性,就是改建生物的基因,因此狭义的遗传工程就是基因工程。 对多数生物来说,基因本质是DNA,基因工程就是要改建DNA,涉及DNA序列的重新组合和建造,所以基因工程的核心就是人工的DNA 重组(DNa recombination)。 十 Tmm 号舞腾 B的DNA片段 染色体DNA 目的DNA 重甜戴体 宿主细胞 宿主细购的转化与含重组 载体的宿主细旅的师出 已转化的宿士细胞 宿士解胞繁殖 含该重组装体的宿主细张克隆株 图20·1基本工程的基本程序 重组、建造的DNA分子只有纯化繁殖才有意义。纯的无性繁殖系统称为克隆。纯化繁殖DNA就称为DNA克隆或分子克隆,基因的纯化繁 殖就称为基因克隆。所以DNA重组和分子克隆是与基因工程密切不可分的,是基因工程技术的核心和主要组成部分。重组DNA、分子克隆甚 至成了基因工程的代名词。 只有当人类对遗传现象本质和规律有深入的认识,才能按人类的意志去改造或创建生物的遗传特性。20世纪50-60年代分子遗传学的迅速 发展,确定了主要遗传物质DNA的双螺旋结构、阐明了遗传信息传递的中心法则、破译了遗传密码,为基因工程奠定了理论基础;同时酶学、 细菌学、病毒学的发展,为基因工程提供了必要的工具。1972-I973年Boyer、.Cohn和Berg等创立了DNA克隆技术,打破了种属的界限,第- 次使本来只存在于真核细胞中的蛋白质能够在大肠杆菌中合成,这是基因工程诞生的里程碑。科学界公认基因工程的出现是20世纪最重要的科 学成就这一,标志人类主动改造生物界的能力进入新的阶段。分子生物学的成就是DNA重组技术和基因工程出现和发展的基础,而DNA重组 技术和基因工程的发展又有力地推动若分子生物学的进步。 基因工程属于生物技术范畴,生物技术(biotechnology)不是一个独立的学科而是一套技术或手段。广义的生物技术指任何利用活的生物 体或其一部分生产产品或改良生物品质的技术;狭义的生物技术是专指以DN重组技术和单克隆技术为标志发展起来的新技术。如无特别说 明,通常生物技术一词就专指新的生物技术而言。一般认为这新的生物技术包括基因工程、细胞工程、酶工程和发酵工程几方面的内容。基因 工程是生物技术的核心和关键,是主导技术:细胞技术是生物技术的基础:酶工程是生物技术的条件;发酵工程是生物技术获得最终产品的手 段,四个方面相互联系的。生物技术是一个综合技术体系,其中基因工程和细胞融合技术最为突出。蛋白质工程(protein engineering)则是 在基因工程基础上综合蛋白质化学、蛋白质晶体学、计算机学辅助设计等知识和技术发展起来的研究新领域,开创了按人类意愿设计和研制人 类需要的蛋白质的新时期,被称为第二代基因工程。 基因工程的基本程序见图20-1所示。 第一节工具酶 DNA重组技术中对核酸的“精雕细刻”主要用酶作为工具。分子生物学研究过程中发现的酶,许多都用作工具,表20-列出最常用的几种工 具酶。限制性核酸内切酶(restrictionendonuclease)在重组DNA技术中有重要地位,在此较详细介绍。 一、限制性核酸内切酶的概念 核酸酶可分为两类:核酸外切酶(exonuclease)是从核酸的一端开始,一个接一个把核苷酸水解下来;核酸内切酶(endonuclease)则从核 酸链中间水解3',5'磷酸二酯键,将核酸链切断。很多细菌和细胞中都能识别外来的核酸并将其分解,1962年发现这是因为细菌中含有特异的 核酸内切酶,能识别特定的核酸序列而将核酸切断:同时又伴随有特定的核酸修饰酶,最常见的是甲基化酶,能使细胞自身核酸特定的序列上碱基甲 基化,从而避免受内切酶水解,外来核酸没有这种特异的甲基化修饰,就会被细胞的核酸酶所水解这样细胞就构成了限制一修饰体系,其功能就是
基因工程(geneticengineering)和遗传工程的英语中是同一个词汇。从字面上看,遗传工程就是按人们的意思去改造生物的遗传特性、或创建 具有新遗传物性的生物。遗传是由基因决定的,改建生物的遗传性,就是改建生物的基因,因此狭义的遗传工程就是基因工程。 对多数生物来说,基因本质是DNA,基因工程就是要改建DNA,涉及DNA序列的重新组合和建造,所以基因工程的核心就是人工的DNA 重组(DNa recombination)。 图20-1 基本工程的基本程序 重组、建造的DNA分子只有纯化繁殖才有意义。纯的无性繁殖系统称为克隆。纯化繁殖DNA就称为DNA克隆或分子克隆,基因的纯化繁 殖就称为基因克隆。所以DNA重组和分子克隆是与基因工程密切不可分的,是基因工程技术的核心和主要组成部分。重组DNA、分子克隆甚 至成了基因工程的代名词。 只有当人类对遗传现象本质和规律有深入的认识,才能按人类的意志去改造或创建生物的遗传特性。20世纪50-60年代分子遗传学的迅速 发展,确定了主要遗传物质DNA的双螺旋结构、阐明了遗传信息传递的中心法则、破译了遗传密码,为基因工程奠定了理论基础;同时酶学、 细菌学、病毒学的发展,为基因工程提供了必要的工具。1972-1973年Boyer、Cohn和Berg等创立了DNA克隆技术,打破了种属的界限,第一 次使本来只存在于真核细胞中的蛋白质能够在大肠杆菌中合成,这是基因工程诞生的里程碑。科学界公认基因工程的出现是20世纪最重要的科 学成就这一。标志人类主动改造生物界的能力进入新的阶段。分子生物学的成就是DNA重组技术和基因工程出现和发展的基础,而DNA重组 技术和基因工程的发展又有力地推动着分子生物学的进步。 基因工程属于生物技术范畴,生物技术(biotechnology)不是一个独立的学科而是一套技术或手段。广义的生物技术指任何利用活的生物 体或其一部分生产产品或改良生物品质的技术;狭义的生物技术是专指以DNA重组技术和单克隆技术为标志发展起来的新技术。如无特别说 明,通常生物技术一词就专指新的生物技术而言。一般认为这新的生物技术包括基因工程、细胞工程、酶工程和发酵工程几方面的内容。基因 工程是生物技术的核心和关键,是主导技术;细胞技术是生物技术的基础;酶工程是生物技术的条件;发酵工程是生物技术获得最终产品的手 段,四个方面相互联系的。生物技术是一个综合技术体系,其中基因工程和细胞融合技术最为突出。蛋白质工程(protein engineering)则是 在基因工程基础上综合蛋白质化学、蛋白质晶体学、计算机学辅助设计等知识和技术发展起来的研究新领域,开创了按人类意愿设计和研制人 类需要的蛋白质的新时期,被称为第二代基因工程。 基因工程的基本程序见图20-1所示。 第一节 工具酶 DNA重组技术中对核酸的“精雕细刻”主要用酶作为工具。分子生物学研究过程中发现的酶,许多都用作工具,表20-列出最常用的几种工 具酶。限制性核酸内切酶(restrictionendonuclease)在重组DNA技术中有重要地位,在此较详细介绍。 一、限制性核酸内切酶的概念 核酸酶可分为两类:核酸外切酶(exonuclease)是从核酸的一端开始,一个接一个把核苷酸水解下来;核酸内切酶(endonuclease)则从核 酸链中间水解3’,5’磷酸二酯键,将核酸链切断。很多细菌和细胞中都能识别外来的核酸并将其分解,1962年发现这是因为细菌中含有特异的 核酸内切酶,能识别特定的核酸序列而将核酸切断;同时又伴随有特定的核酸修饰酶,最常见的是甲基化酶,能使细胞自身核酸特定的序列上碱基甲 基化,从而避免受内切酶水解,外来核酸没有这种特异的甲基化修饰,就会被细胞的核酸酶所水解.这样细胞就构成了限制一修饰体系,其功能就是

保护自身的DNA,分解外来的DNA,以保护和维持自身遗传信息的稳定,这对细菌的生存和繁衍具有重要意义。这就是限制性核酸内切酶名称 中“限制”二字概念的由来。 二、限制性核酸内切酶的命名 按酶的来源的属、种名而定,取属名的第一个字母与种名的头两个字母组成的三个斜体字母作略语表示;如有株名,再加上一个字母,其 后再按发现的先后写上罗马数字。例如:从流感嗜血杆菌d株(Haemophilus influenzae d)中先后分离到3种限制酶,则分别命名为HindI、 Hind和HindIl. 三、限制性核酸内切酶的分类 按限制酶的组成、与修饰酶活性关系,切断核酸的情况不同,分为三类: I类限制性核酸内切酶由3种不同亚基构成,兼具有修饰酶活性和依赖于ATP的限制性内切酶活性,它能识别和结合于特定的DN序列位 点,去随机切断在识别位点以外的DNA序列,通常在识别位点周围400-700bp。这类酶的作用需要Mg2+,S腺苷甲硫氨酸及ATP. Ⅱ类限制性核酸内切酶与1类酶相似,是多亚蛋白质,既有内切酶活性,又有修饰酶活性,切断位点在识别序列周围25-30p范围内,酶促 反应除Mg2+外,也需要ATP供给能量, Ⅲ类限制性核酸内切酶只由一条肽链构成,仅需Mg2+,切割DNA特异性最强,且就在识别位点范围内切断DNA。是分子生物学中应用 最广的限制性内切酶。通常在重组DNA技术提到的限制性核酸内切酶主要指Ⅱ类酶而言。 表20-1DNA重组技术中最常用的工具酶 确 主要用途 限制性核酸钠切酶 识别DNA特定序列,切断DNA链 @缺口平移制作标记DNA探针 ②合成cDNA的第二链 DNA聚合酶I或其大片段(Klenow) ③填补双链DNA3'凹端 ④DNA序列分析 耐热DNA聚合酶(Tag DNA聚合酶等) 聚合酶链反应(PCR) DNA连接 连接两个DNA分子或片段 多核苷酸激 催化多核苷酸5羟基末端磷酸化,制备末端标记探针 未端转移酶 在3末端加入同质多聚物尾 $核酸确,绿豆核酸酶 降解单链DNA或RNA,使双链DNA突出端变为平端 DNA端 降解DNA,在双链DNA上产生随机切口 RNAA 降解除RNA 磷酸 切除核酸末端磷酸基 四、限制性核酸内切酶的作用 大部分限制性核酸内切酶识别DNA序列具有回文结构特征,切断的双链DNA都产生5磷酸基和3'羟基末端。不同限制性核酸内切酶识别和 切割的特异性不同,结果有三种不同的情况: ①产生3'突出粘性末端(cohesive end):以Eoor为例: 5'...GAATT C...35'...Gp OHTTAAC...3" 3'...C ATAAG...5'EooP I 3'...CTTAAOH pG...5' ②产生5'突出的粘性末端:以PstI为例: 5'...CTGCALG...3'5'...CTGCAp OHG...3' 3'...GACGTC...5'PstI 3'...GOH pACGTC...5 ③产生平未端(blunt end):NruI为例: 5'...TCGICGA...35'...TCGp OHCGA...3' 3'...AGCGCT...5'Nru I3'...AGCOhpGCT...5 不同有限制性核酸内切酶识别的DNA序列可以不相同。有的识别四核苷酸序列,有的识别六或八核苷酸序列。如果DNA中的核苷酸序列 是随机排列的,则一个识别四核苷酸序列的内切酶平均每隔256即出现一次该酶的识别切割位点,同样的对识别六或八核苷酸序列的内切酶则 大致上分别是每隔4kb或6Skb出现一次识别切割位点。按此可大致估计一个未知的DNA分子限制性内切酶可能具有切点频率,以便选用合适的 内切酶。 限制性核酸内切酶的种类很多,至今已发现近8O0多种,可以根据它们对DNA有不同的识别序列和切割特征选用,从而为基因工程提供了 有力的工具。表20-2列出了几种最常用的限制性核酸内切酶的识别序列和切割点。 表20·2几种最常用的限制性核酸内切酶 限制性核酸内切酶名称 识别序列和切割点 BamHI GIGATCe ClaI ATICGAT EooR I GIAATTC Hind III AJAGCTT
保护自身的DNA,分解外来的DNA,以保护和维持自身遗传信息的稳定,这对细菌的生存和繁衍具有重要意义。这就是限制性核酸内切酶名称 中“限制”二字概念的由来。 二、限制性核酸内切酶的命名 按酶的来源的属、种名而定,取属名的第一个字母与种名的头两个字母组成的三个斜体字母作略语表示;如有株名,再加上一个字母,其 后再按发现的先后写上罗马数字。例如:从流感嗜血杆菌d株(Haemophilus influenzae d)中先后分离到3种限制酶,则分别命名为HindⅠ、 HindⅡ和HindⅢ。 三、限制性核酸内切酶的分类 按限制酶的组成、与修饰酶活性关系,切断核酸的情况不同,分为三类: Ⅰ类限制性核酸内切酶 由3种不同亚基构成,兼具有修饰酶活性和依赖于ATP的限制性内切酶活性,它能识别和结合于特定的DNA序列位 点,去随机切断在识别位点以外的DNA序列,通常在识别位点周围400-700bp。这类酶的作用需要Mg2+,S腺苷甲硫氨酸及ATP。 Ⅱ类限制性核酸内切酶 与Ⅰ类酶相似,是多亚蛋白质,既有内切酶活性,又有修饰酶活性,切断位点在识别序列周围25-30bp范围内,酶促 反应除Mg2+外,也需要ATP供给能量。 Ⅲ类限制性核酸内切酶 只由一条肽链构成,仅需Mg2+,切割DNA特异性最强,且就在识别位点范围内切断DNA。是分子生物学中应用 最广的限制性内切酶。通常在重组DNA技术提到的限制性核酸内切酶主要指Ⅱ类酶而言。 表20-1 DNA重组技术中最常用的工具酶 酶 主要用途 限制性核酸内切酶 识别DNA特定序列,切断DNA链 DNA聚合酶Ⅰ或其大片段(Klenow) ①缺口平移制作标记DNA探针 ②合成cDNA的第二链 ③填补双链DNA3’凹端 ④DNA序列分析 耐热DNA聚合酶(Taq DNA聚合酶等) 聚合酶链反应(PCR) DNA连接酶 连接两个DNA分子或片段 多核苷酸激酶 催化多核苷酸5’羟基末端磷酸化,制备末端标记探针 末端转移酶 在3’末端加入同质多聚物尾 SI核酸酶,绿豆核酸酶 降解单链DNA或RNA,使双链DNA突出端变为平端 DNA端酶Ⅰ 降解DNA,在双链DNA上产生随机切口 RNA酶A 降解除RNA 磷酸酶 切除核酸末端磷酸基 四、限制性核酸内切酶的作用 大部分限制性核酸内切酶识别DNA序列具有回文结构特征,切断的双链DNA都产生5’磷酸基和3’羟基末端。不同限制性核酸内切酶识别和 切割的特异性不同,结果有三种不同的情况: ①产生3’突出粘性末端(cohesive end):以Eoor 为例: 5’…G↓AATT C…3’→5’…Gp OHTTAAC…3’ 3’…C ATAA↑G…5’EooP Ⅰ 3'… CTTAAOH pG…5' ②产生5’突出的粘性末端:以PstⅠ为例: 5’…CTGCA↓G…3’→5’…CTGCAp OHG…3’ 3’…G↑ACGTC…5’PstⅠ 3’…GOH pACGTC…5 ③产生平末端(blunt end):Nru Ⅰ为例: 5’…TCG↓CGA…3’→5’…TCGp OHCGA…3’ 3’…AGC↑GCT…5’Nru Ⅰ3’…AGCOhpGCT…5’ 不同有限制性核酸内切酶识别的DNA序列可以不相同。有的识别四核苷酸序列,有的识别六或八核苷酸序列。如果DNA中的核苷酸序列 是随机排列的,则一个识别四核苷酸序列的内切酶平均每隔256bp出现一次该酶的识别切割位点,同样的对识别六或八核苷酸序列的内切酶则 大致上分别是每隔4kb或65kb出现一次识别切割位点。按此可大致估计一个未知的DNA分子限制性内切酶可能具有切点频率,以便选用合适的 内切酶。 限制性核酸内切酶的种类很多,至今已发现近800多种,可以根据它们对DNA有不同的识别序列和切割特征选用,从而为基因工程提供了 有力的工具。表20-2列出了几种最常用的限制性核酸内切酶的识别序列和切割点。 表20-2 几种最常用的限制性核酸内切酶 限制性核酸内切酶名称 识别序列和切割点 BamHⅠ Cla Ⅰ EooR Ⅰ Hind Ⅲ G↓GATCc AT↓CGAT G↓AATTC A↓AGCTT

HindII GTPyIPuAC KpnI GGTACIC NotI GCJGGCCGC PstI CTGCAIG SalI GITCGAC Sau3A I IGATC SfiI GGCCNNNNINGGCC Sma I CCCIGGG Xba I TICTAGA Xho I CITCGAG 第二节 基因工程载体 基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分离或改建 的基因和核酸序列自身不能繁殖,需要载体携带它们到合适的细胞中复制和表现功能。对理想的基因工程载体一般至少有以下几点要求: ①能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力。 ②容易进入宿主细胞,而且进入效率越高越好。 ③容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制。这就要求载体DNA上要有合适的限制性核酸内切酶位点。 ④容易从宿主细胞中分离纯化出来,这才便于重组操作。 ⑤有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。这才介于克隆操 作。 常用的载体有质粒,噬菌体和病毒等。 一、质粒载体 质粒(plasmid))是细菌或细胞染色质以外的,能自主复制的,与细菌或细胞共生的遗传成分。其特点如下: ①是染色质外的双链共价闭合环形DNA(covalentlyclosed circuar DNA,cccDNA),可自然形成超螺旋结构,不同质粒大小在2-30Okb之 间,<15kb的小质粒比较容易分离纯化,>15kb的大质粒则不易提取。 ②能自主复制,是能独立复制的复制子(autonomous replicon)。一般质粒DNA复制的质粒可随宿主细胞分裂而传给后代。按质粒复制的 调控及其拷贝数可分两类:严紧控制(stringent control)型质粒的复制常与宿主的繁殖偶联,拷贝数较少,每个细胞中只有1个到十几个拷 贝;另一类是松弛控制(relaxed control)型质粒,其复制宿主不偶联,每个细胞中有几十到几百个拷贝。每个质粒DNA上都有复制的起点, 只有能被宿主细胞复制蛋白质识别的质粒才能在该种细胞中复制,不同质粒复制控制状况主要与复制起点的序列结构相关。有的质粒的可以 整合到宿主细胞染色质DNA中,随宿主DNA复制,称为附加体,例如细菌的性质粒就是一种附加体,它可以质粒形式存在,也能整合入细菌 的DNA,又能从细菌染色质DNA上切下来。F因子携带基因编码的蛋白质能使两个细菌间形成纤毛状细管连接的接合(conjugation),通过这 细管遗传物质可在两个细菌间传递。 ③质粒对宿主生存并不是必需的。这点不同于线粒体,线粒体DN也是环状双链分子,也有独立复制的调控,但线粒体的功能是细胞生存 所必需的。线粒体是细胞的一部分,质粒也往往有其表型,其表现不是宿主生存所必需的,但也不妨碍宿主的生存。某些质粒携带的基因功能 有利于宿主细胞的特定条件下生存,例如,细菌中许多天然的质粒带有抗药性基因,如编码合成能分解破坏四环素、氯霉素、氨苄表霉素等的 酶基因,这种质粒称为抗药性质粒,又称R质粒,带有R质粒的细菌就能在相应的抗生素存在生存繁殖。所以质粒对宿主不是寄生的,而是共 生的。医学上遇到许多细菌的抗药性,常与R质粒在细菌间的传播有关,F质粒就能促使这种传递
HindⅡ KpnⅠ Not Ⅰ Pst Ⅰ Sal Ⅰ Sau3A Ⅰ Sfi Ⅰ Sma Ⅰ Xba Ⅰ Xho Ⅰ GTPy↓PuAC GGTAC↓C GC↓GGCCGC CTGCA↓G G↓TCGAC ↓GATC GGCCNNNN↓NGGCC CCC↓GGG T↓CTAGA C↓TCGAG 第二节 基因工程载体 基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分离或改建 的基因和核酸序列自身不能繁殖,需要载体携带它们到合适的细胞中复制和表现功能。对理想的基因工程载体一般至少有以下几点要求: ①能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力。 ②容易进入宿主细胞,而且进入效率越高越好。 ③容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制。这就要求载体DNA上要有合适的限制性核酸内切酶位点。 ④容易从宿主细胞中分离纯化出来,这才便于重组操作。 ⑤有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。这才介于克隆操 作。 常用的载体有质粒,噬菌体和病毒等。 一、质粒载体 质粒(plasmid)是细菌或细胞染色质以外的,能自主复制的,与细菌或细胞共生的遗传成分。其特点如下: ①是染色质外的双链共价闭合环形DNA(covalentlyclosed circuar DNA,cccDNA),可自然形成超螺旋结构,不同质粒大小在2-300kb之 间,<15kb的小质粒比较容易分离纯化,>15kb的大质粒则不易提取。 ②能自主复制,是能独立复制的复制子(autonomous replicon)。一般质粒DNA复制的质粒可随宿主细胞分裂而传给后代。按质粒复制的 调控及其拷贝数可分两类:严紧控制(stringent control)型质粒的复制常与宿主的繁殖偶联,拷贝数较少,每个细胞中只有1个到十几个拷 贝;另一类是松弛控制(relaxed control)型质粒,其复制宿主不偶联,每个细胞中有几十到几百个拷贝。每个质粒DNA上都有复制的起点, 只有ori能被宿主细胞复制蛋白质识别的质粒才能在该种细胞中复制,不同质粒复制控制状况主要与复制起点的序列结构相关。有的质粒的可以 整合到宿主细胞染色质DNA中,随宿主DNA复制,称为附加体,例如细菌的性质粒就是一种附加体,它可以质粒形式存在,也能整合入细菌 的DNA,又能从细菌染色质DNA上切下来。F因子携带基因编码的蛋白质能使两个细菌间形成纤毛状细管连接的接合(conjugation),通过这 细管遗传物质可在两个细菌间传递。 ③质粒对宿主生存并不是必需的。这点不同于线粒体,线粒体DNA也是环状双链分子,也有独立复制的调控,但线粒体的功能是细胞生存 所必需的。线粒体是细胞的一部分,质粒也往往有其表型,其表现不是宿主生存所必需的,但也不妨碍宿主的生存。某些质粒携带的基因功能 有利于宿主细胞的特定条件下生存,例如,细菌中许多天然的质粒带有抗药性基因,如编码合成能分解破坏四环素、氯霉素、氨芐表霉素等的 酶基因,这种质粒称为抗药性质粒,又称R质粒,带有R质粒的细菌就能在相应的抗生素存在生存繁殖。所以质粒对宿主不是寄生的,而是共 生的。医学上遇到许多细菌的抗药性,常与R质粒在细菌间的传播有关,F质粒就能促使这种传递
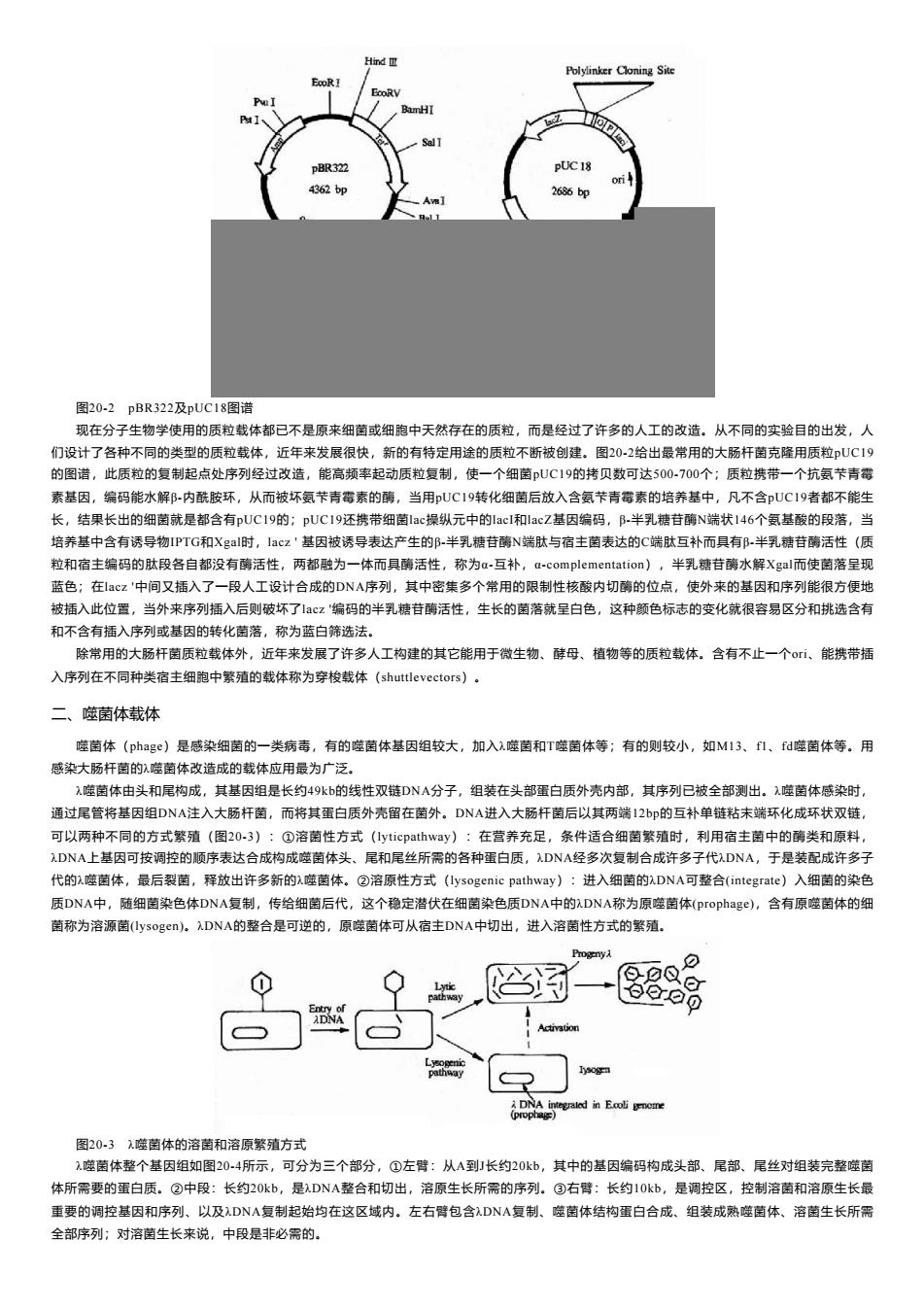
HindⅢ Polylinker Cloning Site EcoRI EooRV BamHI pBR322 PUC 18 ori 4362bp A】 2686bp 图20-2pBR322及pUC18图谱 现在分子生物学使用的质粒载体都已不是原来细菌或细胞中天然存在的质粒,而是经过了许多的人工的改造。从不同的实验目的出发,人 们设计了各种不同的类型的质粒载体,近年来发展很快,新的有特定用途的质粒不断被创建。图20-2给出最常用的大肠杆菌克隆用质粒UC19 的图谱,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌UC19的拷贝数可达500700个;质粒携带一个抗氨卡青霉 素基因,编码能水解郢-内酰胺环,从而被坏氨苄青霉素的酶,当用UC19转化细菌后放入含氨苄青霉素的培养基中,凡不含pUC19者都不能生 长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacl和lacZ基因编码,B-半乳糖苷酶N端状146个氨基酸的段落,当 培养基中含有诱导物IPTG和Xgal时,lacz'基因被诱导表达产生的邹-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有B-半乳糖苷酶活性(质 粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为a-互补,-complementation),半乳糖苷酶水解Xgal而使菌落呈现 蓝色;在lcz'中间又插入了一段人工设计合成的DA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地 被插入此位置,当外来序列插入后则破坏了lcz'编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有 和不含有插入序列或基因的转化菌落,称为蓝白筛选法。 除常用的大肠杆菌质粒载体外,近年来发展了许多人工构建的其它能用于微生物、酵母、植物等的质粒载体。含有不止一个o、能携带插 入序列在不同种类宿主细胞中繁殖的载体称为穿梭载体(shuttlevectors)。 二、噬菌体载体 噬菌体(phage)是感染细菌的一类病毒,有的噬菌体基因组较大,加入).噬菌和T噬菌体等;有的则较小,如M13、f1、f阳噬菌体等。用 感染大肠杆菌的,噬菌体改造成的载体应用最为广泛。 ),噬菌体由头和尾构成,其基因组是长约49k的线性双链DNA分子,组装在头部蛋白质外壳内部,其序列已被全部测出。,噬菌体感染时, 通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。DNA进入大肠杆菌后以其两端I2b的互补单链粘未端环化成环状双链, 可以两种不同的方式繁殖(图20-3):①溶菌性方式(lyticpathway):在营养充足,条件适合细菌繁殖时,利用宿主菌中的酶类和原料, DNA上基因可按调控的顺序表达合成构成噬菌体头、尾和尾丝所需的各种蛋白质,DNA经多次复制合成许多子代).DNA,于是装配成许多子 代的.噬菌体,最后裂菌,释放出许多新的,噬菌体。②溶原性方式(lysogenic pathway):进入细菌的,DNA可整合(integrate)入细菌的染色 质DNA中,随细菌染色体DNA复制,传给细菌后代,这个稳定潜伏在细菌染色质DNA中的,DNA称为原噬菌体(prophage),含有原噬菌体的细 菌称为溶源菌(lysoger)。DNA的整合是可逆的,原噬菌体可从宿主DNA中切出,进入溶菌性方式的繁殖. ⊙ 图20-31噬菌体的溶菌和溶原繁殖方式 )噬菌体整个基因组如图20-4所示,可分为三个部分,①左臂:从A到J长约20kb,其中的基因编码构成头部、尾部、尾丝对组装完整噬菌 体所需要的蛋白质。②中段:长约2Okb,是λDNA整合和切出,溶原生长所需的序列。③右臂:长约1Okb,是调控区,控制溶菌和溶原生长最 重要的调控基因和序列、以及)DNA复制起始均在这区域内。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生长所需 全部序列:对溶菌生长来说,中段是非必需的
图20-2 pBR322及pUC18图谱 现在分子生物学使用的质粒载体都已不是原来细菌或细胞中天然存在的质粒,而是经过了许多的人工的改造。从不同的实验目的出发,人 们设计了各种不同的类型的质粒载体,近年来发展很快,新的有特定用途的质粒不断被创建。图20-2给出最常用的大肠杆菌克隆用质粒pUC19 的图谱,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌pUC19的拷贝数可达500-700个;质粒携带一个抗氨芐青霉 素基因,编码能水解β-内酰胺环,从而被坏氨芐青霉素的酶,当用pUC19转化细菌后放入含氨芐青霉素的培养基中,凡不含pUC19者都不能生 长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacI和lacZ基因编码,β-半乳糖苷酶N端状146个氨基酸的段落,当 培养基中含有诱导物IPTG和Xgal时,lacz ' 基因被诱导表达产生的β-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有β-半乳糖苷酶活性(质 粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为α-互补,α-complementation),半乳糖苷酶水解Xgal而使菌落呈现 蓝色;在lacz '中间又插入了一段人工设计合成的DNA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地 被插入此位置,当外来序列插入后则破坏了lacz '编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有 和不含有插入序列或基因的转化菌落,称为蓝白筛选法。 除常用的大肠杆菌质粒载体外,近年来发展了许多人工构建的其它能用于微生物、酵母、植物等的质粒载体。含有不止一个ori、能携带插 入序列在不同种类宿主细胞中繁殖的载体称为穿梭载体(shuttlevectors)。 二、噬菌体载体 噬菌体(phage)是感染细菌的一类病毒,有的噬菌体基因组较大,加入λ噬菌和T噬菌体等;有的则较小,如M13、f1、fd噬菌体等。用 感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。 λ噬菌体由头和尾构成,其基因组是长约49kb的线性双链DNA分子,组装在头部蛋白质外壳内部,其序列已被全部测出。λ噬菌体感染时, 通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。DNA进入大肠杆菌后以其两端12bp的互补单链粘末端环化成环状双链, 可以两种不同的方式繁殖(图20-3):①溶菌性方式(lyticpathway):在营养充足,条件适合细菌繁殖时,利用宿主菌中的酶类和原料, λDNA上基因可按调控的顺序表达合成构成噬菌体头、尾和尾丝所需的各种蛋白质,λDNA经多次复制合成许多子代λDNA,于是装配成许多子 代的λ噬菌体,最后裂菌,释放出许多新的λ噬菌体。②溶原性方式(lysogenic pathway):进入细菌的λDNA可整合(integrate)入细菌的染色 质DNA中,随细菌染色体DNA复制,传给细菌后代,这个稳定潜伏在细菌染色质DNA中的λDNA称为原噬菌体(prophage),含有原噬菌体的细 菌称为溶源菌(lysogen)。λDNA的整合是可逆的,原噬菌体可从宿主DNA中切出,进入溶菌性方式的繁殖。 图20-3 λ噬菌体的溶菌和溶原繁殖方式 λ噬菌体整个基因组如图20-4所示,可分为三个部分,①左臂:从A到J长约20kb,其中的基因编码构成头部、尾部、尾丝对组装完整噬菌 体所需要的蛋白质。②中段:长约20kb,是λDNA整合和切出,溶原生长所需的序列。③右臂:长约10kb,是调控区,控制溶菌和溶原生长最 重要的调控基因和序列、以及λDNA复制起始均在这区域内。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生长所需 全部序列;对溶菌生长来说,中段是非必需的

利用噬菌体作载体,主要是将外来目的DNA替代或插入中段序列,使其随左右臂一起包装成噬菌体,去感染大肠杆菌,并随噬菌体的溶 菌繁殖而繁殖。现在广泛使用的噬菌体载体也是已作过许多人工改造的,主要的改造是:@设计去除DNA上的一些限制性酶切点。这是因为 DNA较大,序列中的限制性酶切点过多,妨碍其应用。②在中段非必需区,替换插入某些标志基因如上述的可供蓝白筛选lac-lacZ'序列,和 多克隆位点等。由此可构建出两类噬菌体作载体;一类是插入型载体,可将外来序列插中段,常用的gt系列载体,一般容许插入57kb外来 DNA;另一类是转换型载体,即可用外来DNA替代中段,如IMBL系列载体。 Kb 10 49 晚 头部蛋白 尾都置白 乌区 整合,重组 费 AWBDEFZ UVGTHMLKJ 胜恋dN阳o0PQSR A Phage COS A BE C E D 裂解生长非必要 Wam Eam 缺失 d gtWES-1B 图20-4野生型,噬菌体DNA及相应的1噬菌体DNA图谱 插入或置换中段外来的DNA长度是有一定限制的,当噬菌体DNA长度大于野生型)噬菌体基因组I05%或小于78%时,包装而成的噬菌体存 活力显著下降。所以噬菌体载体可插入长5-2Okb的外来DNA,这比质粒载体能插入的DNA长得多;而且包装的,噬菌体感染大肠杆菌要比质 粒转化细菌的效率高得多,所以)噬菌体载体常用于构建cDNA文库或基因组文库。但λ噬菌体载体的克隆操作要比质粒载体复杂。 如果将左右臂和中段都去除,仅留下DNA而端包装噬菌体所必需的cos序列,再加上质粒的复制序列、标志基因、多克隆位点等,就可构 成cos质粒或称为粘粒的载体。粘粒可插入45kb长的外源DNA,然后用入噬菌体外壳蛋白包装成噬菌体,感染大肠杆菌后,粘粒的DNA能以质 粒的形式在细菌中繁殖而被克隆。所以粘粒主要用于DNA文库的构建。 三、动物病毒载体 质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。感染动物的病毒可改造用作动物细胞的载体。由于动物细胞的培养和 操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。使载体及其携带的外来序列能方便地在细菌中繁殖 和克隆,然后再引入真核细胞。目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus40)、逆转录病毒和昆虫杆状病毒等,使用这 些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等(见后)· 人基因组十分庞大,约含4×109bp,建立和筛选人的基因组文库,要求有容量更大的载体,酵母人工染色体(yeast artificial chromosome,YAC)载体应运而生。YAC含有酵母染色体端粒(telesome)、着丝点(centromere)及复制起点等功能序列,可插入长度达200: 500kb的外源DNA,导入酵母细胞可以随细胞分裂周期复制繁殖供作克隆,成为人基因组研究计划的重要 第三节目的序列与载体的连接 将目的基因或序列插入载体,主要靠DNA连接酶和双链DNA粘末端单链序列互补结合的配合使用。有以下主要的方式。 一、粘性末端连接 如果目的序列两端有与载体上相同的限制性核酸内切酶位点,则同一限制酶切开产生的粘末端,在降低温度退火时,能重新互补结合,在 DNA连接酶催化下,目的序列就与载体DNA链相连接(见图20-5)
利用λ噬菌体作载体,主要是将外来目的DNA替代或插入中段序列,使其随左右臂一起包装成噬菌体,去感染大肠杆菌,并随噬菌体的溶 菌繁殖而繁殖。现在广泛使用的λ噬菌体载体也是已作过许多人工改造的,主要的改造是:①设计去除λDNA上的一些限制性酶切点。这是因为 λDNA较大,序列中的限制性酶切点过多,妨碍其应用。②在中段非必需区,替换插入某些标志基因如上述的可供蓝白筛选lacI-lacZ’序列,和 多克隆位点等。由此可构建出两类λ噬菌体作载体;一类是插入型载体,可将外来序列插中段,常用的λgt系列载体,一般容许插入5-7kb外来 DNA;另一类是转换型载体,即可用外来DNA替代中段,如IMBL系列载体。 图20-4 野生型λ噬菌体DNA及相应的λ噬菌体DNA图谱 插入或置换中段外来的DNA长度是有一定限制的,当噬菌体DNA长度大于野生型λ噬菌体基因组105%或小于78%时,包装而成的噬菌体存 活力显著下降。所以λ噬菌体载体可插入长5-20kb的外来DNA,这比质粒载体能插入的DNA长得多;而且包装的λ噬菌体感染大肠杆菌要比质 粒转化细菌的效率高得多,所以λ噬菌体载体常用于构建cDNA文库或基因组文库。但λ噬菌体载体的克隆操作要比质粒载体复杂。 如果将左右臂和中段都去除,仅留下λDNA而端包装噬菌体所必需的cos序列,再加上质粒的复制序列、标志基因、多克隆位点等,就可构 成cos质粒或称为粘粒的载体。粘粒可插入45kb长的外源DNA,然后用λ噬菌体外壳蛋白包装成噬菌体,感染大肠杆菌后,粘粒的DNA能以质 粒的形式在细菌中繁殖而被克隆。所以粘粒主要用于DNA文库的构建。 三、动物病毒载体 质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。感染动物的病毒可改造用作动物细胞的载体。由于动物细胞的培养和 操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。使载体及其携带的外来序列能方便地在细菌中繁殖 和克隆,然后再引入真核细胞。目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus 40)、逆转录病毒和昆虫杆状病毒等,使用这 些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等(见后)。 人 基 因 组 十 分 庞 大 , 约 含 4×109bp , 建 立 和 筛 选 人 的 基 因 组 文 库 , 要 求 有 容 量 更 大 的 载 体 , 酵 母 人 工 染 色 体 ( yeast artificial chromosome,YAC)载体应运而生。YAC含有酵母染色体端粒(telesome)、着丝点(centromere)及复制起点等功能序列,可插入长度达200- 500kb的外源DNA,导入酵母细胞可以随细胞分裂周期复制繁殖供作克隆,成为人基因组研究计划的重要 第三节 目的序列与载体的连接 将目的基因或序列插入载体,主要靠DNA连接酶和双链DNA粘末端单链序列互补结合的配合使用。有以下主要的方式。 一、粘性末端连接 如果目的序列两端有与载体上相同的限制性核酸内切酶位点,则同一限制酶切开产生的粘末端,在降低温度退火时,能重新互补结合,在 DNA连接酶催化下,目的序列就与载体DNA链相连接(见图20-5)