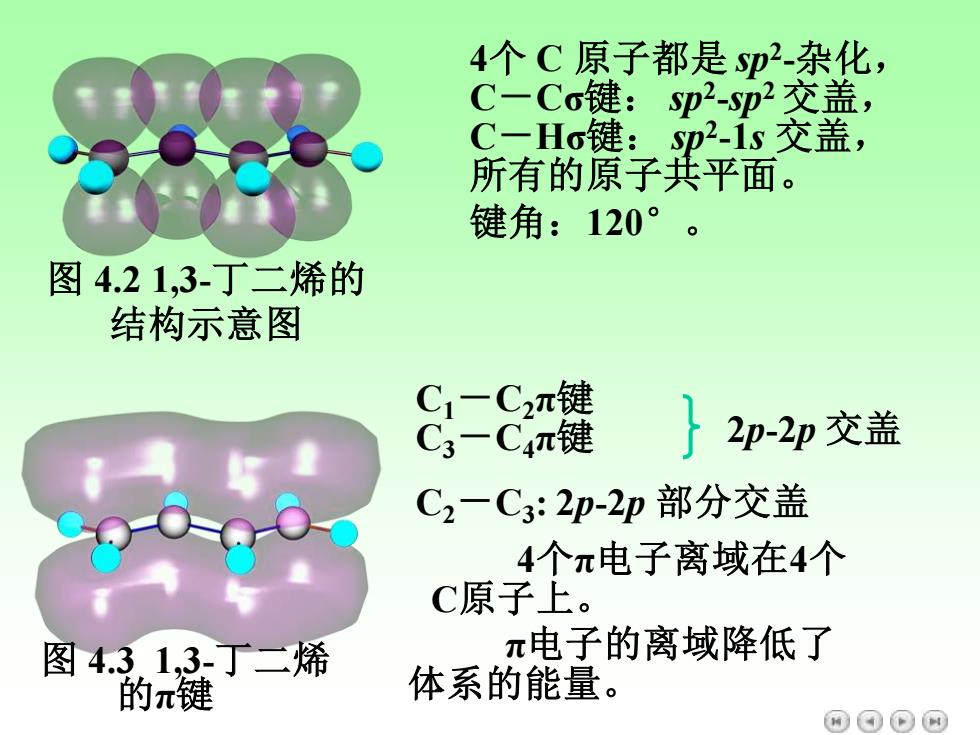
4个C原子都是Sp2-杂化, C-Co键:sp2-p2交盖, C-Ho键:Sp21s交盖, 所有的原子共平面。 键角:120°。 图4.21,3-丁二烯的 结构示意图 8- 2p-2p交盖 C2-C3:2p-2p部分交盖 4个π电子离域在4个 C原子上。 图4.31,3-丁二烯 π电子的离域降低了 的π键 体系的能量。 ⊙⊙
4个 C 原子都是 sp2 -杂化, C-Cσ键: sp2 -sp2 交盖, C-Hσ键: sp2 -1s 交盖, 所有的原子共平面。 键角:120° 。 图 4.2 1,3-丁二烯的 结构示意图 图 4.3 1,3-丁二烯 的π键 C1-C2π键 C3-C4π键 2p-2p 交盖 C2-C3 : 2p-2p 部分交盖 4个π电子离域在4个 C原子上。 π电子的离域降低了 体系的能量
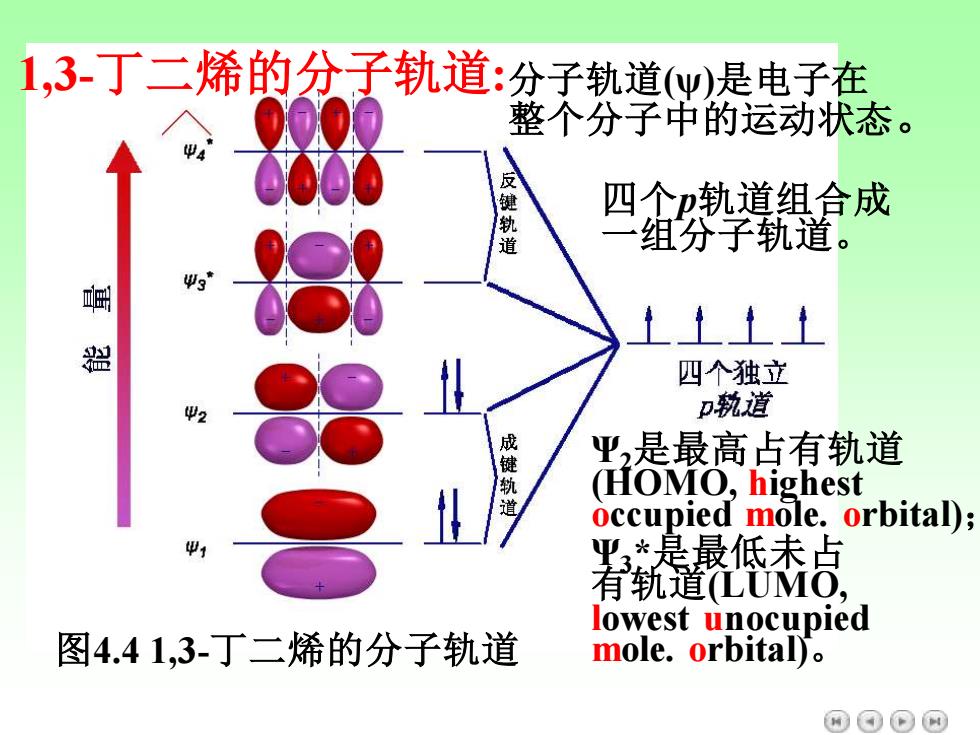
1,3-丁二烯的分子轨道:分子轨道y是电子在 整个分子中的运动状态。 键 四个p轨道组合成 道 组分子轨道。 1上上1 器 四个独立 D轨道 成键轨道 平2是最高占有轨道 (HOMO,highest occupied mole.orbital); 业*是最低未点 有轨道LUMO, lowest unocupied 图4.41,3-丁二烯的分子轨道 mole.orbital). 网⊙⊙网
图4.4 1,3-丁二烯的分子轨道 1,3-丁二烯的分子轨道: 四个p轨道组合成 一组分子轨道。 Ψ2是最高占有轨道 (HOMO, highest occupied mole. orbital); Ψ3 *是最低未占 有轨道(LUMO, lowest unocupied mole. orbital)。 分子轨道(ψ)是电子在 整个分子中的运动状态

4.3电子离域与共轭体系 4.3.1π-π共轭体系 CH2=CH一CH=CH2 1,3-丁二烯 1,3-丁二烯分子中,碳碳单键键长0.147nm 比乙烷碳碳单键键长0.154nm短,由此可见 1,3-丁二烯分子中碳碳之间的键长趋于平均化。 ⊙⊙
4.3 电子离域与共轭体系 4.3.1 π-π共轭体系 CH2 CH CH CH2 1,3-丁二烯 1,3-丁二烯分子中,碳碳单键键长0.147nm, 比乙烷碳碳单键键长0.154nm短,由此可见 1,3-丁二烯分子中碳碳之间的键长趋于平均化

CH2=CH-CHECH2 CH-CH-CHF-CH2 在1,3丁二烯的分子中,四个π电子是在四个碳原子的 分子轨道中运动,这种现象称为电子的离域。 这样的分子成为共轭分子。 这种单键和双键交替排列的体系称为元,π共轭体系。 这种离域的结果,使其电子云密度的分布有所改变, 从而使其内能更小,分子更稳定,键长趋于平均化, 这样由于共轭产生的效应叫做共轭效应。 由π电子离域所体现的共轭效应称为π,π共轭效应
这种离域的结果,使其电子云密度的分布有所改变, 从而使其内能更小,分子更稳定,键长趋于平均化, 这样由于共轭产生的效应叫做共轭效应。 在1,3-丁二烯的分子中,四个π电子是在四个碳原子的 分子轨道中运动,这种现象称为电子的离域。 这样的分子成为共轭分子。 这种单键和双键交替排列的体系称为π,π共轭体系。 由π电子离域所体现的共轭效应称为π,π共轭效应。 CH2 CH CH CH2 CH2 CH CH CH2

从氢化热可以看出共轭体系的稳定性: CH3CH=CHCH=CH2+2H2-CH3CH2CH2CH2CH3 共轭双烯 氢化热226kJ/mo1 CH2=CHCH2CH=CH2+2H2-CH3CH2CH2CH2CH3 隔离双烯 氢化热 254kJ/mol △E=254kJ/mol- 226kJ/mol=28kJ/mol (共轭能或离域能) ⊙⊙⊙
CH3 CH2 CH2 CH2 CH3 CH3 CH2 CH2 CH2 CH3 254kJ/mol- 226kJ/mol=28kJ/mol △E= (共轭能或离域能) 共轭双烯 隔离双烯 CH3 CH CHCH CH2 2H2 氢化热 226kJ/mol CH2 CHCH2 CH CH2 2H2 氢化热 254kJ/mol 从氢化热可以看出共轭体系的稳定性: