
人徐子大理?院 教学大纲 (1)滴定分析的特点及方法分类 (2)滴定分析对化学反应的要求 (3)标准溶液的配制及浓度的标定 标准溶液的浓度表示:标准溶液的配制方法 (4)滴定分析结果计算 2.教学要求 (1)初步掌握标准溶液的配制和标定 (2)熟悉滴定分析对化学反应的要求 (3)了解滴定分析法的特点和类别 3.教学重点和难点 重点:标准溶液的配制与标定 难点:滴定分析的有关计算 (三)分析试样的采集与制备 1.教学内容 (1)试样采集 (2)试样制备 (3)试样分解 2.教学要求 (1)了解试样的采取、制备与分解的方法: (2)了解试样的制备与分解在定量分析中的地位 3.教学重点和难点 重点:样品采集与制备 难点:样品采集与制备:样品的分解方法 (四)分析化学中的误差与数据处理 1,教学内容 (1)分析化学中的误差 (2)有效数字及其运算规则 (3)分析化学中的数据处理 2.教学要求 (1)掌握准确度与精密度的表示方法和有效数字的运算法则 (2)熟悉异常值取舍和显著性检验以及误差产生的原因及减免方法 (3)了解回归分析法 3.教学重点和难点 重点:误差表示方法:有效数字及其运算:置信区间
教学大纲 16 (1)滴定分析的特点及方法分类 (2)滴定分析对化学反应的要求 (3)标准溶液的配制及浓度的标定 标准溶液的浓度表示;标准溶液的配制方法 (4)滴定分析结果计算 2.教学要求 (1) 初步掌握标准溶液的配制和标定 (2) 熟悉滴定分析对化学反应的要求 (3) 了解滴定分析法的特点和类别 3.教学重点和难点 重点:标准溶液的配制与标定 难点:滴定分析的有关计算 (三)分析试样的采集与制备 1.教学内容 (1) 试样采集 (2) 试样制备 (3) 试样分解 2.教学要求 (1)了解试样的采取、制备与分解的方法; (2)了解试样的制备与分解在定量分析中的地位 3.教学重点和难点 重点:样品采集与制备 难点:样品采集与制备;样品的分解方法 (四)分析化学中的误差与数据处理 1.教学内容 (1)分析化学中的误差 (2)有效数字及其运算规则 (3)分析化学中的数据处理 2.教学要求 (1)掌握准确度与精密度的表示方法和有效数字的运算法则 (2)熟悉异常值取舍和显著性检验以及误差产生的原因及减免方法 (3)了解回归分析法 3.教学重点和难点 重点:误差表示方法;有效数字及其运算;置信区间

具信子大理:院 教学大纲 难点:置信区间:显著性检验:误差产生的原因及减免 (五)分析化学中的质量保证与质量控制(自主学习) (六)酸碱滴定法(部分自主学习) 1,教学内容 (1)酸碱质子理论 酸碱定义:酸碱反应实质:酸碱强度 (2)酸度对平衡体系中各型体分布系数的影响 分析浓度与平衡浓度:酸的浓度和酸度:酸度对弱酸(碱)型体分布系数的影响 (3)酸碱溶液中酸碱度计算 强酸碱:一元弱酸(碱):多元弱酸(碱):两性物质:缓冲溶液 (4)酸碱指示剂 变色原理:变色范围 (5)酸碱滴定 强酸碱互滴:一元弱酸(碱)滴定:多元弱酸(碱)滴定 (6)酸碱滴定法的计算示例(混合碱分析) 2.教学要求 ()掌握各种酸碱溶液中pH值的计算:指示剂选择原则:酸碱滴定条件判断:酸碱滴 定结果计算 (2)熟悉酸碱质子理论:酸碱平衡中各型体的分布 3.教学重点和难点 重点:酸碱溶液中酸碱度计算:酸碱指示剂选择原则:酸碱滴定曲线:酸碱滴定结果计 难点:酸碱平衡体系中各型体的分布、质子条件:酸碱溶液中酸碱度计算 (七)配位滴定法 1.教学内容 (1)概述 (2)乙二胺四乙酸及其二钠盐 乙二胺四乙酸及其二钠盐:EDTA的分析特性 (3)配合物在溶液中的离解平衡 配合物的稳定常数及各级配合物的分布:影响配位平衡的主要因素:配合物的条件稳定 常数 (4)配位滴定指示剂 金属指示剂的作用原理:金属指示剂条件:指示剂的变色范围 (5)配位滴定法基本原理
教学大纲 17 难点:置信区间;显著性检验;误差产生的原因及减免 (五)分析化学中的质量保证与质量控制(自主学习) (六)酸碱滴定法(部分自主学习) 1.教学内容 (1)酸碱质子理论 酸碱定义;酸碱反应实质;酸碱强度 (2)酸度对平衡体系中各型体分布系数的影响 分析浓度与平衡浓度;酸的浓度和酸度;酸度对弱酸(碱)型体分布系数的影响 (3)酸碱溶液中酸碱度计算 强酸碱;一元弱酸(碱);多元弱酸(碱);两性物质;缓冲溶液 (4)酸碱指示剂 变色原理;变色范围 (5)酸碱滴定 强酸碱互滴;一元弱酸(碱)滴定;多元弱酸(碱)滴定 (6)酸碱滴定法的计算示例(混合碱分析) 2.教学要求 (1) 掌握各种酸碱溶液中 pH 值的计算;指示剂选择原则;酸碱滴定条件判断;酸碱滴 定结果计算 (2) 熟悉酸碱质子理论;酸碱平衡中各型体的分布 3.教学重点和难点 重点:酸碱溶液中酸碱度计算;酸碱指示剂选择原则;酸碱滴定曲线;酸碱滴定结果计 算 难点:酸碱平衡体系中各型体的分布、质子条件;酸碱溶液中酸碱度计算 (七)配位滴定法 1.教学内容 (1)概述 (2)乙二胺四乙酸及其二钠盐 乙二胺四乙酸及其二钠盐;EDTA 的分析特性 (3)配合物在溶液中的离解平衡 配合物的稳定常数及各级配合物的分布;影响配位平衡的主要因素;配合物的条件稳定 常数 (4)配位滴定指示剂 金属指示剂的作用原理;金属指示剂条件;指示剂的变色范围 (5)配位滴定法基本原理

人徐子大理?优 教学大纲 滴定曲线:影响突跃范围大小的主要因素及准确滴定条件:配位滴定的最低pH值及酸 效应曲线 (6)提高配位滴定选择性的方法 2.教学要求 (1)掌握条件稳定常数计算:金属离子能够被准确滴定的判别式:根据酸效应曲线掌 握滴定金属离子最低pH的计算:配位滴定结果的计算: (2)熟悉滴定曲线 (3)了解EDTA配合物的特点:各级配合物分布:副反应系数:金属指示剂作用原理: 分步滴定条件:提高配位滴定选择性的方法 3.教学重点和难点 重点:条件稳定常数:准确滴定条件;滴定金属离子最低pH: 难点:条件稳定常数:分步滴定条件:提高配位滴定选择性的方法 (八)氧化还原滴定法 1.教学内容 (1)方法特点及分类 (2)氧化还原平衡 条件电极电位:氧化还原反应进行的程度 (3)氧化还原滴定曲线 (4)氧化还原指示剂 (5)常用氧化还原滴定法 KMnO,法:K,CrO,法;碘量法 2.教学要求 (1)掌握高锰酸钾法,重铬酸钾法,碘量法的原理,应用及有关计算:掌握化学计量 点电位的计算 (2)熟悉氧化还原反应进行的程度,突跃范围及影响因素,氧化还原滴定曲线 (3)了解条件电极电位的意义及应用,氧化还原指示剂 3.教学重点和难点 重点:氧化还原滴定(化学计量点及滴定突跃范围的电位计算):高锰酸钾法,重铬酸钾 法,碘量法的原理:滴定分析结果计算 难点:条件电极电位:滴定分析结果计算 (九)沉淀滴定法(部分自主学习) 1.教学内容 (1)沉淀滴定法概述 (2)常用银量法的滴定原理及终点确定:莫尔法:佛尔哈德法:法扬司法
教学大纲 18 滴定曲线;影响突跃范围大小的主要因素及准确滴定条件;配位滴定的最低 pH 值及酸 效应曲线 (6)提高配位滴定选择性的方法 2.教学要求 (1)掌握条件稳定常数计算;金属离子能够被准确滴定的判别式;根据酸效应曲线掌 握滴定金属离子最低 pH 的计算;配位滴定结果的计算; (2)熟悉滴定曲线 (3)了解 EDTA 配合物的特点;各级配合物分布;副反应系数;金属指示剂作用原理; 分步滴定条件;提高配位滴定选择性的方法 3.教学重点和难点 重点:条件稳定常数;准确滴定条件;滴定金属离子最低 pH; 难点:条件稳定常数;分步滴定条件;提高配位滴定选择性的方法 (八)氧化还原滴定法 1.教学内容 (1)方法特点及分类 (2)氧化还原平衡 条件电极电位;氧化还原反应进行的程度 (3)氧化还原滴定曲线 (4)氧化还原指示剂 (5)常用氧化还原滴定法 KMnO4 法;K2Cr2O7法;碘量法 2.教学要求 (1)掌握高锰酸钾法,重铬酸钾法,碘量法的原理,应用及有关计算;掌握化学计量 点电位的计算 (2)熟悉氧化还原反应进行的程度,突跃范围及影响因素,氧化还原滴定曲线 (3)了解条件电极电位的意义及应用,氧化还原指示剂 3.教学重点和难点 重点:氧化还原滴定(化学计量点及滴定突跃范围的电位计算);高锰酸钾法,重铬酸钾 法,碘量法的原理;滴定分析结果计算 难点:条件电极电位;滴定分析结果计算 (九)沉淀滴定法 (部分自主学习) 1.教学内容 (1)沉淀滴定法概述 (2)常用银量法的滴定原理及终点确定:莫尔法;佛尔哈德法;法扬司法

具信子大理:院 教学大纲 2.教学要求 (1)掌握摩尔法、佛尔哈德法的原理和应用:沉淀滴定结果计算 (2)了解法扬司法的原理和应用 3。教学重点和难点 重点:莫尔法、佛尔哈德法的基本原理和滴定条件 难点:法扬司法的基本原理和滴定条件 (十)重量分析法(部分自主学习) 1.教学内容 (1)重量分析法概述:重量分析特点和方法分类,重量分析对沉淀的要求, (2)重量分析结果计算。 (3)影响沉淀溶解度的主要因素:同离子效应,盐效应,副反应(酸效应、配位效应)。 (4)沉淀的形成:沉淀类型,沉淀形成的过程 2.教学要求 (1)掌握重量分析结果计算 (2)了解同离子效应,盐效应,副反应(酸效应、配位效应)对沉淀溶解度 (3)了解沉淀剂的类型和形成过程 3.教学重点和难点 重点:重量分析法结果计算 难点:曼影响沉淀溶解度的主要因素的作用原理 (十一)吸光光度法(部分自主学习) 1.教学内容 (1)物质对光的选择性吸收和光吸收的基本定律 (2)分光光度计及吸收光谱 (3)显色反应及其影响因素 (4)吸光光度分析及误差控制 2.教学要求 (1)掌握吸光光度分析的原理,掌握比尔定律: (2)熟悉分光光度计的结构、吸收光谱的测量条件 (3)了解吸光光度法的误差根源。 3.教学重点和难点 重点:物质对光的选择性吸收和光吸收的基本定律,分光光度计及吸收光谱, 比尔定律,测量条件选择 难点:吸光光度分析及误差控制 (十二)分析化学中常用的分离和富集方法(部分自主学习)
教学大纲 19 2.教学要求 (1)掌握摩尔法、佛尔哈德法的原理和应用;沉淀滴定结果计算 (2)了解法扬司法的原理和应用 3.教学重点和难点 重点:莫尔法、佛尔哈德法的基本原理和滴定条件 难点:法扬司法的基本原理和滴定条件 (十)重量分析法(部分自主学习) 1.教学内容 (1) 重量分析法概述:重量分析特点和方法分类,重量分析对沉淀的要求。 (2) 重量分析结果计算。 (3) 影响沉淀溶解度的主要因素:同离子效应,盐效应,副反应(酸效应、配位效应)。 (4) 沉淀的形成:沉淀类型,沉淀形成的过程。 2.教学要求 (1)掌握重量分析结果计算; (2)了解同离子效应,盐效应,副反应(酸效应、配位效应)对沉淀溶解度 (3)了解沉淀剂的类型和形成过程 3.教学重点和难点 重点:重量分析法结果计算 难点:影响沉淀溶解度的主要因素的作用原理 (十一)吸光光度法 (部分自主学习) 1.教学内容 (1)物质对光的选择性吸收和光吸收的基本定律 (2)分光光度计及吸收光谱 (3)显色反应及其影响因素 (4)吸光光度分析及误差控制 2.教学要求 (1)掌握吸光光度分析的原理,掌握比尔定律; (2)熟悉分光光度计的结构、吸收光谱的测量条件; (3)了解吸光光度法的误差根源。 3. 教学重点和难点 重点:物质对光的选择性吸收和光吸收的基本定律,分光光度计及吸收光谱, 比尔定律,测量条件选择。 难点:吸光光度分析及误差控制。 (十二)分析化学中常用的分离和富集方法 (部分自主学习)
人偏子大理?院 教学大纲 1.教学内容 (1)萃取分离法 (2)离子交换分离法 (3)色谱分离法 2.教学要求 (1)掌握液液茶取的原理 (2)掌握离子交换分离的原理 (3)熟悉离子交换树脂的种类和用途,离子交换分离操作技术 (4)了解离子交换法和色谱法的应用实例 3.教学重点和难点 重点:液液萃取的原理,离子交换分离原理,高子交换树脂,离子交换分离操作技术, 离子交换法应用实例。 难点:离子交换分离操作技术 四、学时分配 总学时32学时,其中理论32学时,实践0学时 建议自主学习18小时。 学时分配如下: 教学内容 理论学时 实践学时 合计 绪论 1 0 1 滴定分析法概论 0 分析试样的采集与制备 1 0 1 分析化学中的误差与数据处理 2 0 分析化学中的质量保证与质量控制 0 酸碱滴定法 6 0 6 配位滴定法 6 0 6 氧化还原滴定法 5 0 沉淀滴定法 0 2 重量分析法 0 2 吸光光度法 0 分析化学中常用的分离和富集方法 2 0 机动 1 0 合计 3 0 32 自主学习内容 建议时间 分析化学中的质量保证与质量控制 1小时
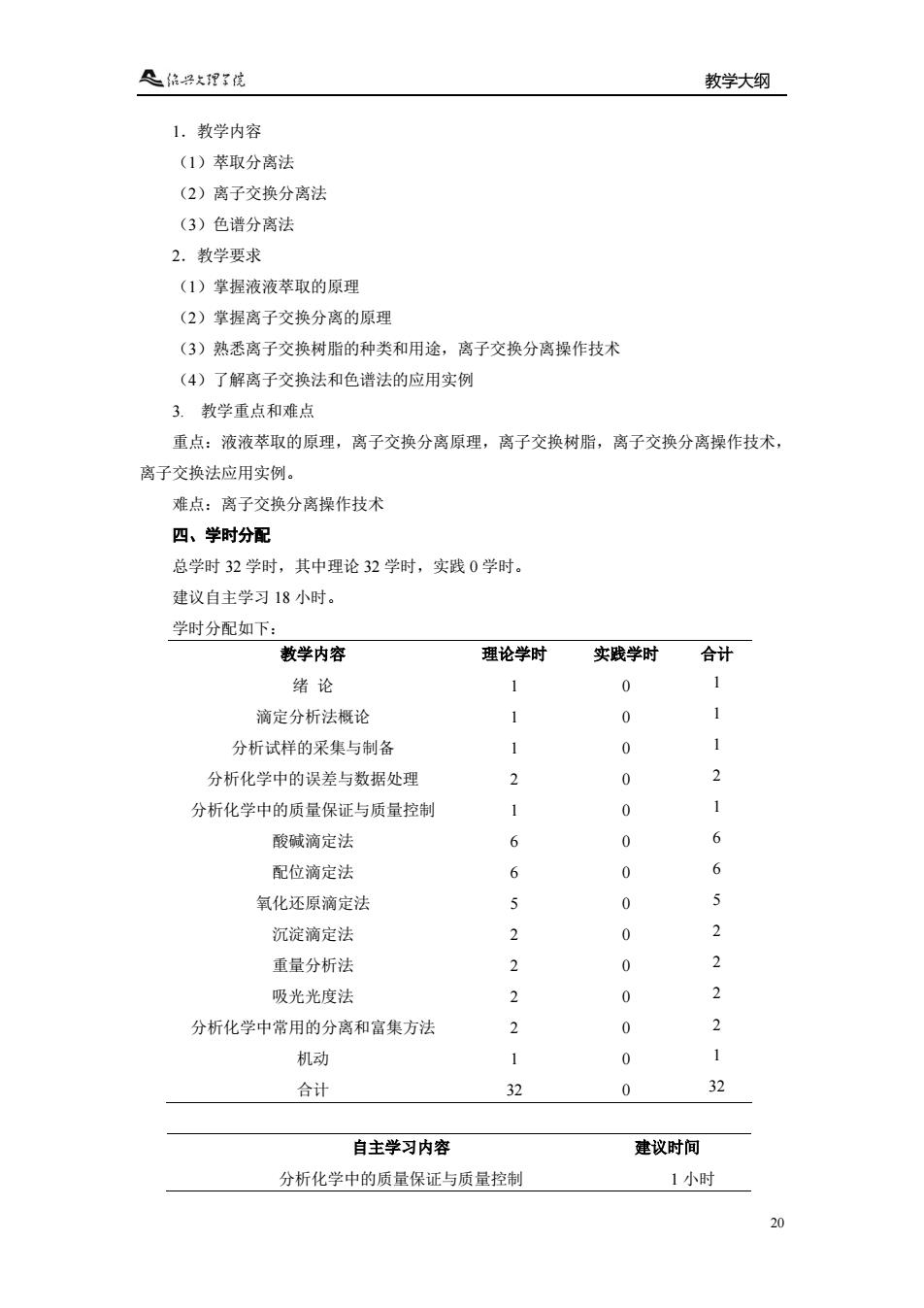
教学大纲 20 1.教学内容 (1)萃取分离法 (2)离子交换分离法 (3)色谱分离法 2.教学要求 (1)掌握液液萃取的原理 (2)掌握离子交换分离的原理 (3)熟悉离子交换树脂的种类和用途,离子交换分离操作技术 (4)了解离子交换法和色谱法的应用实例 3. 教学重点和难点 重点:液液萃取的原理,离子交换分离原理,离子交换树脂,离子交换分离操作技术, 离子交换法应用实例。 难点:离子交换分离操作技术 四、学时分配 总学时 32 学时,其中理论 32 学时,实践 0 学时。 建议自主学习 18 小时。 学时分配如下: 教学内容 理论学时 实践学时 合计 绪 论 1 0 1 滴定分析法概论 1 0 1 分析试样的采集与制备 1 0 1 分析化学中的误差与数据处理 2 0 2 分析化学中的质量保证与质量控制 1 0 1 酸碱滴定法 6 0 6 配位滴定法 6 0 6 氧化还原滴定法 5 0 5 沉淀滴定法 2 0 2 重量分析法 2 0 2 吸光光度法 2 0 2 分析化学中常用的分离和富集方法 2 0 2 机动 1 0 1 合计 32 0 32 自主学习内容 建议时间 分析化学中的质量保证与质量控制 1 小时