
具信子大理:院 教学大纲 衡常数与化学反应的方向。 (3)化学平衡的移动:浓度、压强、温度对化学平衡的影响. (4)自发变化和嫡:热力学第三定律和标准熵:化学反应婶变和热力学第二定律 (5)标准摩尔生成Gibbs函数:Gibbs函数与化学平衡:vanHo开方程 2.教学要求 (1)了解平衡常数的意义及其与吉布斯自由能(△G.°)的关系,△,G°=一RTnK,利用公式 计算平衡常数或△,G°。 (2)了解化学反应等温式,n1HoT方程△,G=△,G.°+RTnQ的意义及其相关的计算与应用.。利 用函数△G。”或AG判衔标准态及非标准态下化学反应的方向性, (3)掌握Q/人作为过程判据的方法。 (4)掌握温度、压力、浓度、催化剂对化学平衡移动的影响以及平衡移动原理,能够根据条件的变化 判断化学反应的移动。 (5)初步了解利用吉布斯一赫姆霍兹公式的计算、理解AG、4从、AS之间的关系:学 会估算热力学分解温度和反应温度等。 3.教学重点和难点 重点:平衡常数与吉布断自由能(△,Gnm)的关系及相关计算,1Hom方程△,Gm=△,G.”十 RTnQ的应用 难点:化学反应方向的判据,化学平衡的移动,熵、自由能的概念、4G、AH、4S的运用 及计算。 (四)酸碱平衡 1.教学内容 (1)酸碱质子理论:质子酸碱的定义:酸碱反应与酸碱的强弱:水的离子积和溶液的 pH值:一元弱酸、弱碱的解离平衡:多元弱酸解离平衡。 (2)酸碱平衡中浓度的计算:酸碱平衡的移动和缓冲溶液。 (3)酸碱理论简介。 2.教学要求 (1)掌握酸碱质子理论理论:了解酸碱电子理论。 (2)掌握影响酸碱平衡的因素及缓冲溶液的缓冲原理。 (3)掌握弱酸、弱碱的解离平衡,水的离子积和溶液的pH值的计算:掌握弱酸强碱 盐、强酸弱碱盐、弱酸弱碱盐、弱酸酸式盐溶液pH值的计算。 3.教学重点和难点 重点:弱酸、弱碱的解离平衡,水的离子积和溶液p值的计算:弱酸强碱盐、强酸弱 碱盐、弱酸弱碱盐、弱酸酸式盐溶液pH值的计算。 难点:缓冲溶液,盐的水解,同离子效应
教学大纲 11 衡常数与化学反应的方向。 (3)化学平衡的移动:浓度、压强、温度对化学平衡的影响。 (4)自发变化和熵;热力学第三定律和标准熵;化学反应熵变和热力学第二定律。 (5)标准摩尔生成 Gibbs 函数;Gibbs 函数与化学平衡;vanHoff 方程。 2.教学要求 (1)了解平衡常数 K ө 的意义及其与吉布斯自由能(ΔrGm ө)的关系,ΔrGm ө=-RTln K ө,利用公式 计算平衡常数 K ө 或 ΔrGm ө。 (2)了解化学反应等温式,Van’t Hoff 方程 ΔrG=ΔrGm ө +RTln Q 的意义及其相关的计算与应用。利 用函数 ΔrGm ө 或 ΔrGm判断标准态及非标准态下化学反应的方向性。 (3)掌握 Q/ K ө 作为过程判据的方法。 (4)掌握温度、压力、浓度、催化剂对化学平衡移动的影响以及平衡移动原理,能够根据条件的变化 判断化学反应的移动。 (5)初步了解利用吉布斯—赫姆霍兹公式的计算、理解⊿G、⊿H、⊿S 之间的关系;学 会估算热力学分解温度和反应温度等。 3.教学重点和难点 重点:平衡常数 K ө 与吉布斯自由能(ΔrGm ө)的关系及相关计算,Van’t Hoff 方程 ΔrGm=ΔrGm ө + RTln Q 的应用。 难点:化学反应方向的判据,化学平衡的移动。熵、自由能的概念、⊿G、⊿H、⊿S 的运用 及计算。 (四)酸碱平衡 1.教学内容 (1)酸碱质子理论:质子酸碱的定义;酸碱反应与酸碱的强弱;水的离子积和溶液的 pH 值;一元弱酸、弱碱的解离平衡;多元弱酸解离平衡。 (2)酸碱平衡中浓度的计算;酸碱平衡的移动和缓冲溶液。 (3)酸碱理论简介。 2.教学要求 (1)掌握酸碱质子理论理论;了解酸碱电子理论。 (2)掌握影响酸碱平衡的因素及缓冲溶液的缓冲原理。 (3)掌握弱酸、弱碱的解离平衡,水的离子积和溶液的 pH 值的计算;掌握弱酸强碱 盐、强酸弱碱盐、弱酸弱碱盐、弱酸酸式盐溶液 pH 值的计算。 3.教学重点和难点 重点:弱酸、弱碱的解离平衡,水的离子积和溶液 pH 值的计算;弱酸强碱盐、强酸弱 碱盐、弱酸弱碱盐、弱酸酸式盐溶液 pH 值的计算。 难点:缓冲溶液,盐的水解,同离子效应

人徐子大理?优 教学大纲 (五)难溶电解质的沉淀溶解平衡 1.教学内容 (1)溶度积原理和溶解度以及溶度积和溶解度之间的关系。 (2)沉淀的生成和溶解:溶度积规则,同离子效应及盐效应。 (3)难溶电解质的沉淀溶解平衡及其移动:酸度对沉淀平衡的影响:配合物的形成对 溶解度的影响。 (4)两种沉淀之间的平衡:分步沉淀,沉淀的转化。 (5)溶度积规则相关计算。 2.教学要求 (1)掌握溶度积原理 (2)熟悉难溶电解质的沉淀溶解平衡移动 (3)了解同离子效应及盐效应 (4)掌握难溶强电解质的溶度积规则及有关计算:熟悉同离子效应、盐效应及沉淀的 转化和分步沉淀。 3。教学重点和难点 溶度积原理沉淀的溶解,沉淀的转化,分步沉淀。 (六)氧化还原反应 1,教学内容 (1)基本概念:化合价和氧化数,氧化还原反应特征,氧化剂和还原剂,氧化还原电 的 (2)氧化还原反应方程式的配平。 (3)电极电势:原电池的概念,原电池的表达形式,电极电势(标准电极电势及非标准电极电势): 电池电动势和化学反应吉布斯自由能的关系:影响电极电势的因素:Ncmt方程:电极电势的应用。 (4)电极电势及其应用。 2.教学要求 (1)掌程氧化还原反应的基木概念,熟悉氧化还原方程式的配平。 (2)熟练应用电极电势讨论元素不同氧化态下的氧化还原性的强弱, (3)熟练判断氧化还原反应的方向及平衡常数的计算。 (4)掌握原电池的表达方式:重点掌握能斯特(Nest)方程式及其应用,熟练进行有关计 算. (5)通过计算来判断非标准状态下氧化还原反应的方向,利用元素索电位图来判断元索价态的隐定性。 3.教学重点和难点 重点:氧化还原反应的基木概念,电极电势,电池电动势,能斯特(Nes)方程式及其应用。 难点:氧化还原方程式的配平。元素不同氧化态下的氧化还原性强弱的判断,非标准状态下氧化还
教学大纲 12 (五)难溶电解质的沉淀溶解平衡 1.教学内容 (1)溶度积原理和溶解度以及溶度积和溶解度之间的关系。 (2)沉淀的生成和溶解:溶度积规则,同离子效应及盐效应。 (3)难溶电解质的沉淀-溶解平衡及其移动:酸度对沉淀平衡的影响;配合物的形成对 溶解度的影响。 (4)两种沉淀之间的平衡:分步沉淀,沉淀的转化。 (5)溶度积规则相关计算。 2.教学要求 (1)掌握溶度积原理 (2)熟悉难溶电解质的沉淀溶解平衡移动 (3)了解同离子效应及盐效应 (4)掌握难溶强电解质的溶度积规则及有关计算;熟悉同离子效应、盐效应及沉淀的 转化和分步沉淀。 3.教学重点和难点 溶度积原理 沉淀的溶解,沉淀的转化,分步沉淀。 (六)氧化还原反应 1.教学内容 (1)基本概念:化合价和氧化数,氧化还原反应特征,氧化剂和还原剂,氧化还原电 对。 (2)氧化还原反应方程式的配平。 (3)电极电势:原电池的概念,原电池的表达形式,电极电势(标准电极电势及非标准电极电势); 电池电动势和化学反应吉布斯自由能的关系;影响电极电势的因素;Nernst 方程;电极电势的应用。 (4)电极电势及其应用。 2.教学要求 (1)掌握氧化还原反应的基本概念,熟悉氧化还原方程式的配平。 (2)熟练应用电极电势讨论元素不同氧化态下的氧化还原性的强弱。 (3)熟练判断氧化还原反应的方向及平衡常数的计算。 (4)掌握原电池的表达方式;重点掌握能斯特(Nernst)方程式及其应用,熟练进行有关计 算。 (5)通过计算来判断非标准状态下氧化还原反应的方向,利用元素电位图来判断元素价态的稳定性。 3.教学重点和难点 重点:氧化还原反应的基本概念,电极电势,电池电动势,能斯特(Nernst)方程式及其应用。 难点:氧化还原方程式的配平,元素不同氧化态下的氧化还原性强弱的判断,非标准状态下氧化还
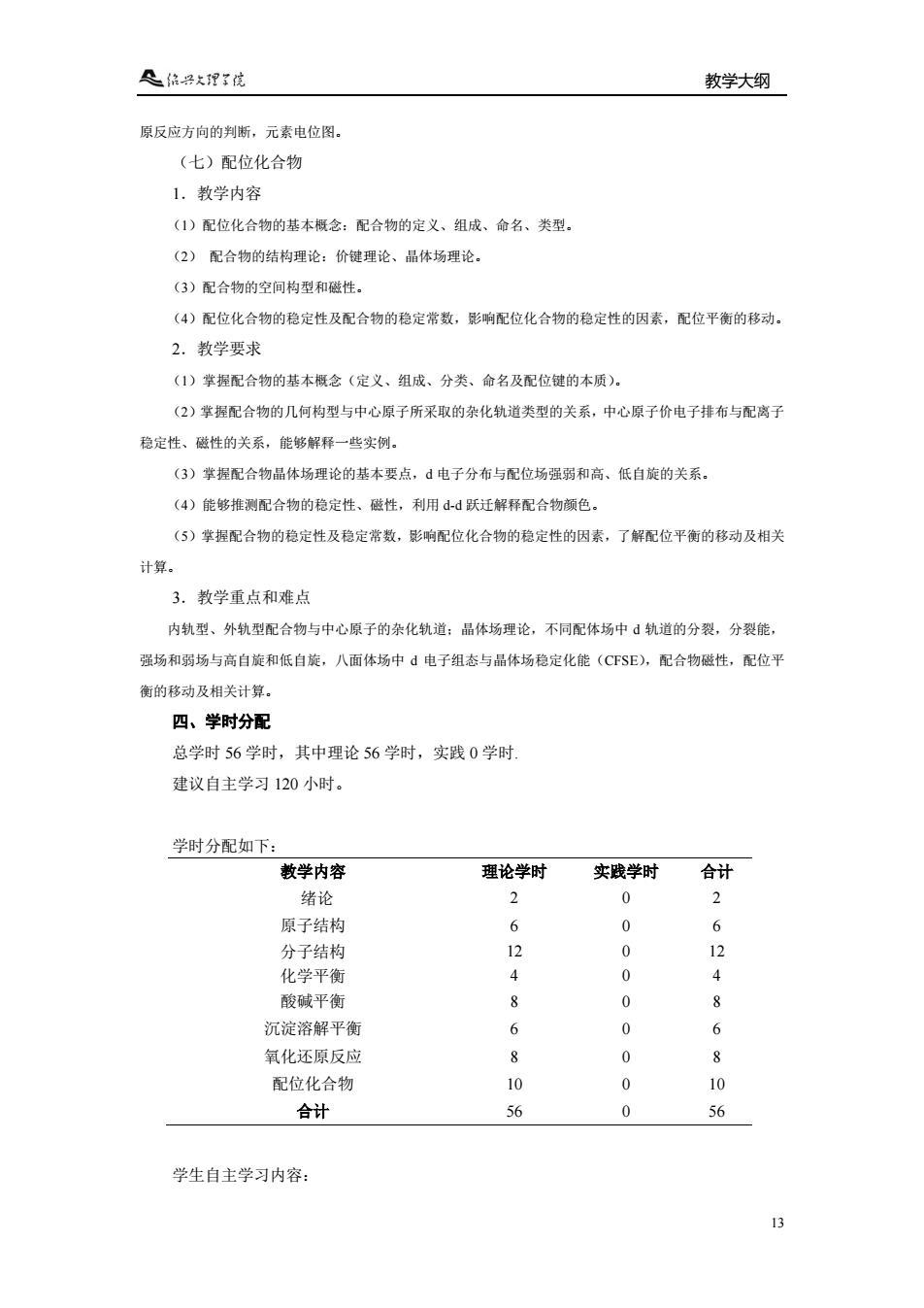
具信子大理?院 教学大纲 原反应方向的判渐,元素电位图。 (七)配位化合物 1.教学内容 (1)配位化合物的基本概念:配合物的定义、组成、命名、类型, (2)配合物的结构理论:价键理论、品体场理论 (3)配合物的空间构型和磁性。 (4)配位化合物的稳定性及配合物的稳定常数,影响配位化合物的稳定性的因素,配位平衡的移动。 2.教学要求 (1)掌提配合物的基本概念(定义、组成、分类、命名及配位键的本质)。 (2)掌握配合物的几何构型与中心原子所采取的杂化轨道类型的关系,中心原子价电子排布与配离子 稳定性、磁性的关系,能够解释一些实例。 (3)掌握配合物晶体场理论的基本要点,d电子分布与配位场强药和高、低自旋的关系 (4)能够推测配合物的稳定性、磁性,利用dd跃迁解释配合物颜色. (5)掌操配合物的镜定性及稳定常数,彭响配位化合物的稳定性的因素,了解配位平衡的移动及相关 计算。 3.教学重点和难点 内轨型、外轨型配合物与中心原子的杂化轨道:品体场理论,不同配体场中轨道的分裂,分裂能 强场和弱场与高自旋和低自旋,八面体场中á电子组态与品体场稳定化能(CFSE),配合物磁性,配位平 衡的移动及相关计算。 四、学时分配 总学时56学时,其中理论56学时,实践0学时 建议自主学习120小时。 学时分配如下: 教学内容 理论学时 实践学时 合计 绪论 2 0 原子结构 0 分子结构 0 12 化学平衡 4 0 4 酸碱平衡 8 0 R 沉淀溶解平衡 6 0 6 氧化还原反应 8 0 配位化合物 0 合计 0 56 学生自主学习内容:
教学大纲 13 原反应方向的判断,元素电位图。 (七)配位化合物 1.教学内容 (1)配位化合物的基本概念:配合物的定义、组成、命名、类型。 (2) 配合物的结构理论:价键理论、晶体场理论。 (3)配合物的空间构型和磁性。 (4)配位化合物的稳定性及配合物的稳定常数,影响配位化合物的稳定性的因素,配位平衡的移动。 2.教学要求 (1)掌握配合物的基本概念(定义、组成、分类、命名及配位键的本质)。 (2)掌握配合物的几何构型与中心原子所采取的杂化轨道类型的关系,中心原子价电子排布与配离子 稳定性、磁性的关系,能够解释一些实例。 (3)掌握配合物晶体场理论的基本要点,d 电子分布与配位场强弱和高、低自旋的关系。 (4)能够推测配合物的稳定性、磁性,利用 d-d 跃迁解释配合物颜色。 (5)掌握配合物的稳定性及稳定常数,影响配位化合物的稳定性的因素,了解配位平衡的移动及相关 计算。 3.教学重点和难点 内轨型、外轨型配合物与中心原子的杂化轨道;晶体场理论,不同配体场中 d 轨道的分裂,分裂能, 强场和弱场与高自旋和低自旋,八面体场中 d 电子组态与晶体场稳定化能(CFSE),配合物磁性,配位平 衡的移动及相关计算。 四、学时分配 总学时 56 学时,其中理论 56 学时,实践 0 学时. 建议自主学习 120 小时。 学时分配如下: 教学内容 理论学时 实践学时 合计 绪论 2 0 2 原子结构 6 0 6 分子结构 化学平衡 12 4 0 0 12 4 酸碱平衡 8 0 8 沉淀溶解平衡 6 0 6 氧化还原反应 8 0 8 配位化合物 10 0 10 合计 56 0 56 学生自主学习内容:

人偏子大理?院 教学大纲 (一)课前预习、课后复习,适应大学教学及学习 该课程为大一新生的课程,学生由于刚进大学,需要逐步适应大学的课程体系及教学力 法,因此,学生的自主学习内容主要是让学生通过课前预习和课后复习及课后必要的习题练 习跟上课堂教师讲课的节奏,掌握该门课程的教学内容。 自主学习内容 建议时间 课前预习、课后复习及作业 120 合计 120 五、学业评价和课程考核 学业评价和课程考核采用过程性和结果性相结合的方式,过程性的方式包括作业、讨论、 课内测试、小论文、期中考试等:结果性的方式包括期末考核、综合大作业、小论文等。本 课程的考核方式是闭卷。笔试(80%~70%,平时成绩(20%~30%),平时成绩包括课堂独立作 业、平时作业、小论文、课堂提问及学生学习态度等。 六、教学反馈 教学反馈采用书面反馈和单独反馈相结合。其中书面反馈指每次作业后在作业本上针对 每人作业情况的反馈:单独反馈为对个人提出的问题进行反馈。书面反馈每章一次,单独反 馈根据学生需要而定,次数不限。 七、教材与参考书 教林: 张天蓝等(编).无机化学(第六版).北京:人民卫生出版社.2014年 参考书: [门傅献彩料主编)·大学化学(上、下册).北京:高等教有出版社.1999年 2]北京师范大学,华中师范大学,南京师范大学无机化学教研室(编).无机化学(第 4版).北京:高等教有出版社.2000年 B]蔡少华等(编).无机化学习题解答.广州:中山大学出版社.2004年 4张德祖,刘双怀,郑化桂(编.无机化学要点例题习题(第三版X高校核心课程复 习指导丛书中国科学院指定).合肥:中国科技大学出版社.2005年 [5]武汉大学、吉林大学等(编).无机化学(第3版)上、下册.北京:高等教育出版社.1994 [6大连理工大学无机化学教研组(编).无机化学(第五版).北京:高等教有出版社.2006 执笔人:令狐文生、蒸静学科主任:李益民教学院长:陶菲菲院长:齐陈泽
教学大纲 14 (一)课前预习、课后复习,适应大学教学及学习 该课程为大一新生的课程,学生由于刚进大学,需要逐步适应大学的课程体系及教学方 法,因此,学生的自主学习内容主要是让学生通过课前预习和课后复习及课后必要的习题练 习跟上课堂教师讲课的节奏,掌握该门课程的教学内容。 自主学习内容 建议时间 课前预习、课后复习及作业 120 合计 120 五、学业评价和课程考核 学业评价和课程考核采用过程性和结果性相结合的方式,过程性的方式包括作业、讨论、 课内测试、小论文、期中考试等;结果性的方式包括期末考核、综合大作业、小论文等。本 课程的考核方式是闭卷。笔试(80%~70%),平时成绩(20%~30%),平时成绩包括课堂独立作 业、平时作业、小论文、课堂提问及学生学习态度等。 六、教学反馈 教学反馈采用书面反馈和单独反馈相结合。其中书面反馈指每次作业后在作业本上针对 每人作业情况的反馈;单独反馈为对个人提出的问题进行反馈。书面反馈每章一次,单独反 馈根据学生需要而定,次数不限。 七、教材与参考书 教 材: 张天蓝等(编).无机化学(第六版).北京:人民卫生出版社.2014 年 参考书: [1]傅献彩(主编) .大学化学(上、下册).北京:高等教育出版社.1999 年 [2]北京师范大学,华中师范大学,南京师范大学无机化学教研室(编).无机化学(第 4 版).北京:高等教育出版社.2000 年 [3]蔡少华等(编).无机化学习题解答.广州:中山大学出版社.2004 年 [4]张德祖,刘双怀,郑化桂(编).无机化学--要点·例题·习题(第三版)(高校核心课程复 习指导丛书 中国科学院指定).合肥:中国科技大学出版社.2005 年 [5]武汉大学、吉林大学等(编).无机化学(第 3 版) 上、下册.北京:高等教育出版社.1994 年 [6]大连理工大学无机化学教研组(编).无机化学(第五版).北京:高等教育出版社.2006 年 执笔人:令狐文生、蔡静 学科主任:李益民 教学院长:陶菲菲 院长:齐陈泽

具偏子大理?院 教学大纲 《分析化学》教学大纲 课程编号:11230028 英文名称:Analytical Chemistry 学分:2 学时:32 课程类别:专业平台课 授课对象:化学、应用化学、高分子材料与工程、药学、轻化工程专业本科学生 教学单位:化学化工学院无机材料学科 修读学期:第2学期 一、教学任务 分析化学是应用化学专业、化学专业、药学专业、轻化工程本科学生必修的主要基础课 程之一。主要内容为化学定量分析。其任务是让学生学习和掌握分析化学理论、分析原理及 分析方法,建立化学中“量”的概念。培养学生从事理论研究和实际工作的能力和严谨的科 学作风。 二、敦学目标 1.专业知识方面:掌握常量组分定量分析的基本知识、基本理论和基本分析方法。 2.专业能力方面:培养学生独立进行分析数据的统计处理,自学和利用参考资料等方 面的能力。 3.综合能力方面:加强教学方法的启发性、针对性、交互式和实效性,培养学生获取 知识的能力和创新意识。 三、教学内容 (一)绪论 1.教学内容 (1)分析化学的任务与作用 (2)分析方法的类别 2.教学要求 了解分析化学的任务与作用和各种分析方法的特点 3.教学重点和难点 重点:分析化学的任务与作用 难点:分析方法的类别 (二)滴定分析法概论 1.教学内容
教学大纲 15 《分析化学》教学大纲 课程编号:11230028 英文名称:Analytical Chemistry 学 分:2 学 时:32 课程类别:专业平台课 授课对象:化学、应用化学、高分子材料与工程、药学、轻化工程专业本科学生 教学单位:化学化工学院无机材料学科 修读学期:第 2 学期 一、教学任务 分析化学是应用化学专业、化学专业、药学专业、轻化工程本科学生必修的主要基础课 程之一。主要内容为化学定量分析。其任务是让学生学习和掌握分析化学理论、分析原理及 分析方法,建立化学中“量”的概念。培养学生从事理论研究和实际工作的能力和严谨的科 学作风。 二、教学目标 1.专业知识方面:掌握常量组分定量分析的基本知识、基本理论和基本分析方法。 2.专业能力方面: 培养学生独立进行分析数据的统计处理,自学和利用参考资料等方 面的能力。 3.综合能力方面:加强教学方法的启发性、针对性、交互式和实效性,培养学生获取 知识的能力和创新意识。 三、教学内容 (一)绪论 1.教学内容 (1)分析化学的任务与作用 (2)分析方法的类别 2.教学要求 了解分析化学的任务与作用和各种分析方法的特点 3.教学重点和难点 重点:分析化学的任务与作用 难点:分析方法的类别 (二)滴定分析法概论 1.教学内容