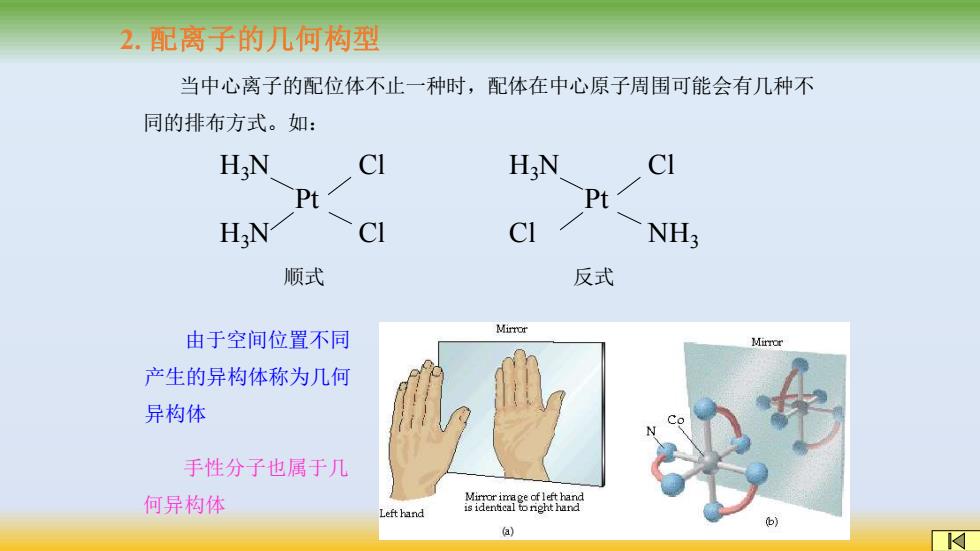
2.配离子的几何构型 当中心离子的配位体不止一种时,配体在中心原子周围可能会有几种不 同的排布方式。如: HN CI H:N CI Pt P H N NH; 顺式 反式 由于空间位置不同 Mirror Mirror 产生的异构体称为几何 异构体 手性分子也属于几 何异构体 Mirror image ofleft hand Left hand is identical to nght hand b (a)
2. 配离子的几何构型 当中心离子的配位体不止一种时,配体在中心原子周围可能会有几种不 同的排布方式。如: H3N H3N Pt Cl Cl H3N Cl Pt Cl NH3 顺式 反式 由于空间位置不同 产生的异构体称为几何 异构体 手性分子也属于几 何异构体

10.2配合物的化学键理论 研究中心离子与配体键合及键合力的本质 10.2.1配合物的配位键理论 主要是Pauling的杂化轨道理论一价键理论 配位键理论的要点: 1.中心离子(原子)必须具有空轨道,以接受配体的孤对电子,形成σ配 键。如:[CoNH,)6]+Co3+(3)可以接受NH的孤对电子,Co3+←-NH 2.中心离子成键过程中能量相近的价层轨道发生杂化,以杂化轨道接受配体 的孤对电子。这就决定了配离子的空间构型、配位数、稳定性等。 配合物中一些常见、重要的杂化轨道: □
10.2 配合物的化学键理论 研究中心离子与配体键合及键合力的本质 10.2.1 配合物的配位键理论 主要是Pauling的杂化轨道理论——价键理论 配位键理论的要点: 1. 中心离子(原子)Mn+必须具有空轨道,以接受配体的孤对电子,形成σ配 键。如:[Co(NH3 )6 ] 3+ Co3+(3d 6 ) 可以接受 :NH3的孤对电子, Co3+←NH3 2. 中心离子成键过程中能量相近的价层轨道发生杂化,以杂化轨道接受配体 的孤对电子。这就决定了配离子的空间构型、配位数、稳定性等。 配合物中一些常见、重要的杂化轨道:
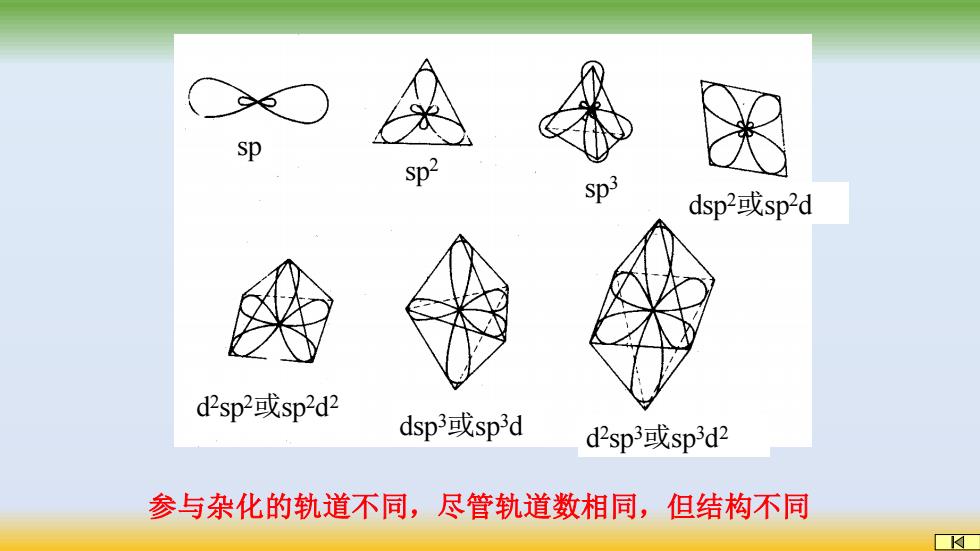
sp Sp2 Sp3 dsp2或sp2d d2sp2或sp2d2 dsp3或sp3d d2sp3或sp3d2 参与杂化的轨道不同,尽管轨道数相同,但结构不同
sp sp2 dsp 2或sp2d d 2 sp 2或sp2d 2 d 2 sp 3或sp3d 2 sp3 dsp 3或sp3d 参与杂化的轨道不同,尽管轨道数相同,但结构不同

3.中心离子(或原子)提供杂化轨道接受配体的孤对电子形成配键时,由于采 用的杂化轨道不同,形成的配合物可分为内轨型和外轨型。如:Fe2+(364s) 4d 4s 3d Ad [Fe(H20)6]2+ pP外轨型 3d 高自旋 Ad [Fe(CN)6]4 Psp3内轨型 3d 低自旋 ☐
3. 中心离子(或原子)提供杂化轨道接受配体的孤对电子形成配键时,由于采 用的杂化轨道不同,形成的配合物可分为内轨型和外轨型。如:Fe2+(3d64s0 ) 3d 4s 4p 4d [Fe(H2O)6 ] 2+ 3d 4s 4p 4d [Fe(CN)6 ] 4- 3d 4s 4p 4d sp3d 2 外轨型 高自旋 d 2 sp3 内轨型 低自旋

再如: 3d 4s Ap Fe" 00000 3d 4s Ap FcN'①①①[①①①①①①] CNCN CNCNCNCN dsp杂化 [FeF ] 3d 4 Ap 4d 0①o00@000①0]OO0 spd杂化 口
再如: