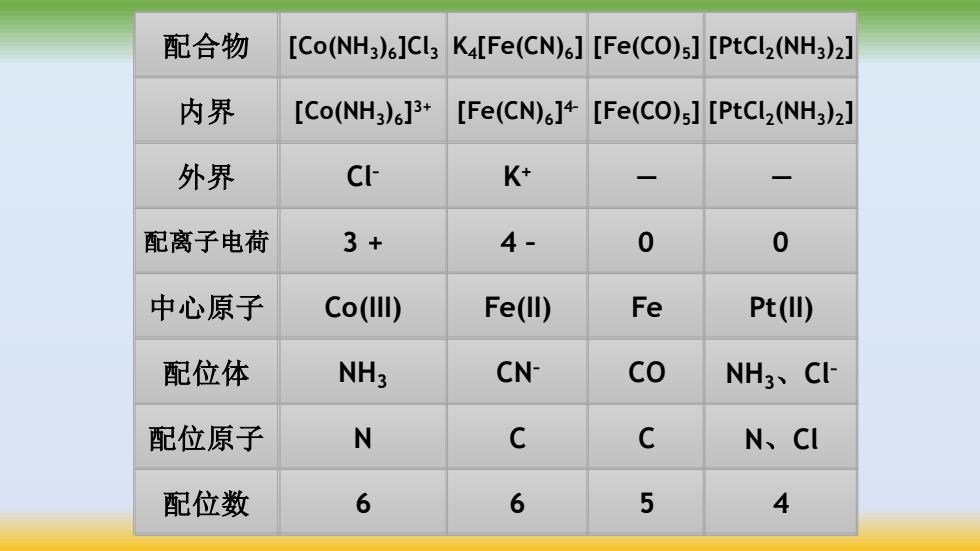
配合物 [Co(NH3)6]Cl3 K[Fe(CN)6][Fe(CO)s][PtCl2(NH3)2] 内界 [Co(NH3)6]3+ [Fe(CN)]+[Fe(CO)s][PtCl2(NH3)2] 外界 C K+ 配离子电荷 3+ 4- 0 0 中心原子 Co(III) Fe(lI) Fe Pt(II) 配位体 NH3 CN- CO NH3、C 配位原子 N C C N、CI 配位数 6 6 5 4
配位数 6 6 5 4 配位原子 N C C N、Cl NH3、Cl NH CN– CO – 配位体 3 中心原子 Co(III) Fe(II) Fe Pt(II) 配离子电荷 3 + 4 – 0 0 外界 Cl– K+ — — [PtCl2 (NH3 )2 [Fe(CO) ] 5 [Fe(CN) ] 6 ] 4– [Co(NH3 )6 ] 内界 3+ [PtCl2 (NH3 )2 [Fe(CO) ] 5 K ] 4 [Fe(CN)6 [Co(NH ] 3 )6 ]Cl 配合物 3
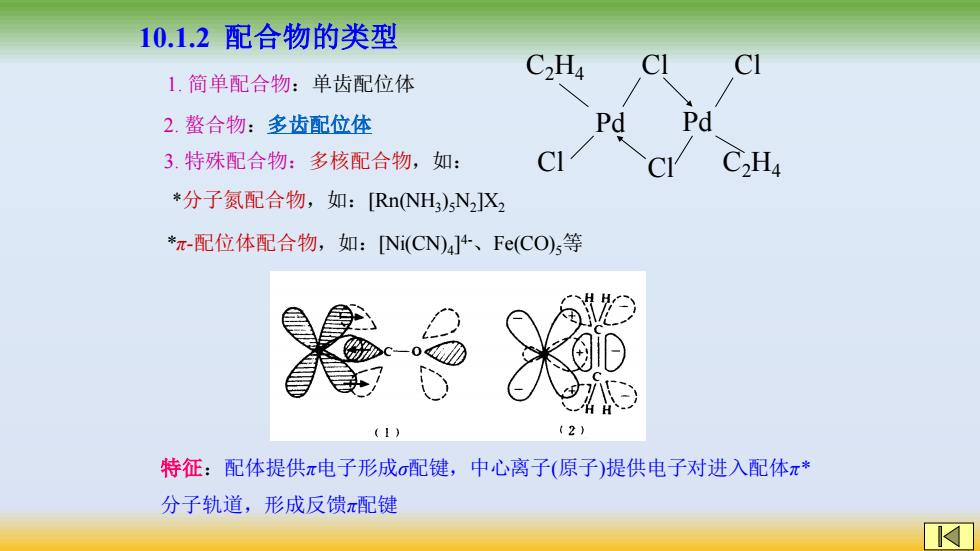
10.1.2配合物的类型 C2H4 CI 1.简单配合物:单齿配位体 2.螯合物:多齿配位体 Pd Pd 3.特殊配合物:多核配合物,如: C2Ha *分子氮配合物,如:[RnNH)sN2JX2 *π-配位体配合物,如:[Ni(CN)4]4、Fe(CO)s等 卷米 特征:配体提供π电子形成σ配键,中心离子(原子)提供电子对进入配体π* 分子轨道,形成反馈π配键
*分子氮配合物,如:[Rn(NH3 )5N2 ]X2 *π-配位体配合物,如:[Ni(CN)4 ] 4-、Fe(CO)5等 特征:配体提供π电子形成σ配键,中心离子(原子)提供电子对进入配体π* 分子轨道,形成反馈π配键 10.1.2 配合物的类型 1. 简单配合物:单齿配位体 2. 螯合物:多齿配位体 3. 特殊配合物:多核配合物,如: C2H4 Cl Pd Cl Cl Pd Cl C2H4

10.1.3配位化合物的命名 主要是内界的命名,举例说明 K2[SiF6] 六氟合硅(V)酸钾 K[PtCls(NH3)] 五氯一氨合铂(V)酸钾 Na[Co(CO)4] 四羰基合钴(-I)酸钠 [Co(ONO)NH)5]SO4硫酸一亚硝酸根·五氨合钴() [Co (NO)(NH)] 三硝基·三氨合钴(山) [Pt(NO2)(NH3)(NH2OH)(Py)]CI 氯化一硝基一氨一羟基一吡啶合铂(Ⅱ) 内界:配位体数一配位体名称(多个配体从左至右依次命名,配体间加“”)一 合一中心离子名称(中心离子氧化数罗马数字) 内界与外界之间:某酸某、某化某 例:写出氯化二氯三氨一水合钴Ⅲ的化学式 [Co(CI2)(NH)(H,O)]CI [CoCI2 (NH)(H2O)JCI
10.1.3 配位化合物的命名 主要是内界的命名,举例说明 K2 [SiF6 ] 六氟合硅(Ⅳ)酸钾 K[PtCl5 (NH3 )] 五氯·一氨合铂(Ⅳ)酸钾 Na[Co(CO)4 ] 四羰基合钴(-Ⅰ)酸钠 [Co(ONO)(NH3 )5 ]SO4 硫酸一亚硝酸根·五氨合钴(Ⅲ) [Co (NO2 )3 (NH3 )3 ] 三硝基·三氨合钴(Ⅲ) [Pt(NO2 )(NH3 )(NH2OH)(Py)]Cl 氯化一硝基·一氨·一羟基·一吡啶合铂(Ⅱ) 内界: 配位体数—配位体名称(多个配体从左至右依次命名,配体间加“·”)— 合—中心离子名称(中心离子氧化数罗马数字) 内界与外界之间:某酸某、某化某 例:写出 氯化二氯·三氨·一水合钴(Ⅲ)的化学式 [Co(Cl2 )(NH3 )3 (H2O)]Cl 或 [CoCl2 (NH3 )3 (H2O)]Cl
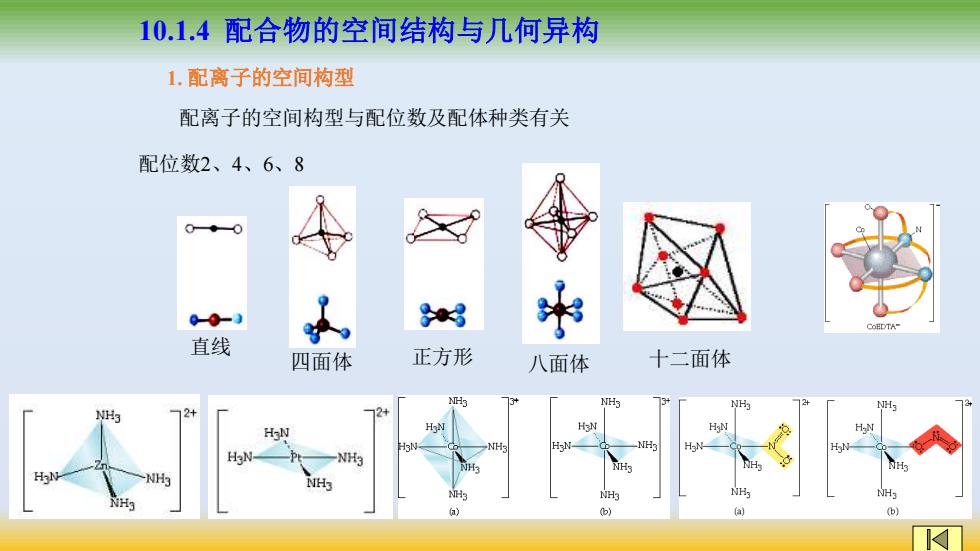
10.1.4配合物的空间结构与几何异构 1.配离子的空间构型 配离子的空间构型与配位数及配体种类有关 配位数2、4、6、8 00-0 3 CoHDTA- 直线 四面体 正方形 八面体 十二面体 NHs 13 H NH3 12+ 72+ HoN HN H-N H3N NH- H H3N- -NH3 NHs -NH3 NHg NH3 NH (b) a
10.1.4 配合物的空间结构与几何异构 1. 配离子的空间构型 配离子的空间构型与配位数及配体种类有关 配位数2、4、6、8 直线 四面体 正方形 八面体 十二面体
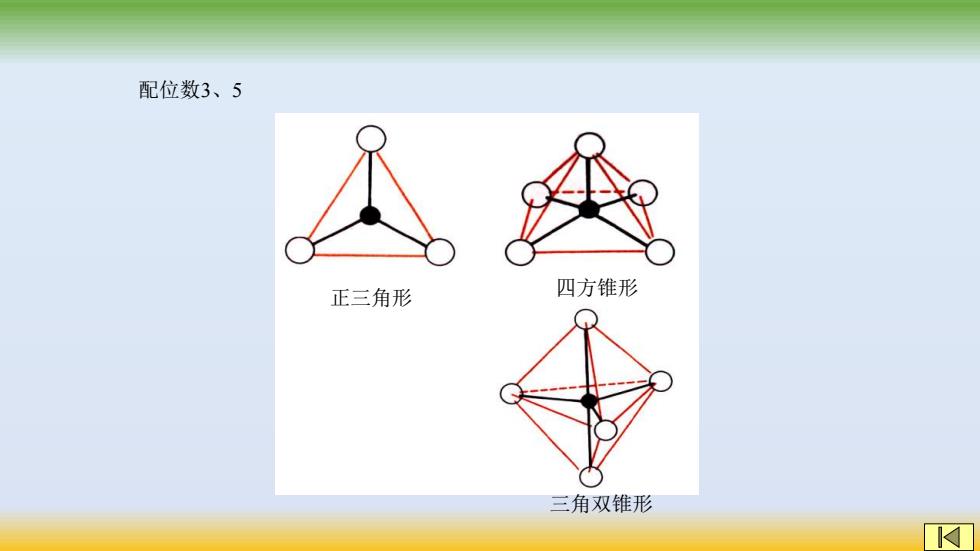
配位数3、5 正三角形 四方锥形 三角双锥形
配位数3、5 正三角形 四方锥形 三角双锥形