
(二) 过氧化氢的鉴别及主要用途 药典规定的H,0,的鉴别方法为:向H02溶 液中加入K2CI07溶液、稀H2S04溶液和乙瞇,生 成蓝色过氧化铬(COs): 4H202+Cr,O3+2H一2Cr0,+5H,0 HO,的主要用途是用作氧化剂,其优点是还 原产物是水,不会引入其他杂质。纯H202可作为 火箭燃料的氧化剂,医药上也利用它的强氧化性 作为杀菌剂,H02还可用作漂白剂、消毒剂、防 毒面具中的氧源等
无机化学 2 + 2 2 2 7 5 2 4H O + Cr O + 2H 2CrO + 5H O − (二) 过氧化氢的鉴别及主要用途 药典规定的 H2O2 的鉴别方法为:向 H2O2 溶 液中加入 K2Cr2O7 溶液、稀H2SO4溶液和乙醚,生 成蓝色过氧化铬(CrO5): H2O2 的主要用途是用作氧化剂,其优点是还 原产物是水,不会引入其他杂质。纯 H2O2 可作为 火箭燃料的氧化剂,医药上也利用它的强氧化性 作为杀菌剂,H2O2 还可用作漂白剂、消毒剂、防 毒面具中的氧源等

四、疏的化合物 (一)硫化氢和金属硫化物 1.硫化氢 硫化氢为无色气体,密度略大于空气,具有 臭鸡蛋气味。硫化氢有剧毒,它不仅刺激眼膜及 呼吸道,而且还能与各种血红蛋白中的铁离子结 合,抑制了它们的活性,阻碍物质的能量代谢。 空气中HS的体积分数为1%时就会引起头痛、 眩晕和恶心,吸入大量HS会引起严重中毒,导 致昏迷甚至死亡
无机化学 四、硫的化合物 (一) 硫化氢和金属硫化物 1. 硫化氢 硫化氢为无色气体,密度略大于空气,具有 臭鸡蛋气味。硫化氢有剧毒,它不仅刺激眼膜及 呼吸道,而且还能与各种血红蛋白中的铁离子结 合,抑制了它们的活性,阻碍物质的能量代谢。 空气中 H2S 的体积分数为1% 时就会引起头痛、 眩晕和恶心,吸入大量 H2S 会引起严重中毒,导 致昏迷甚至死亡
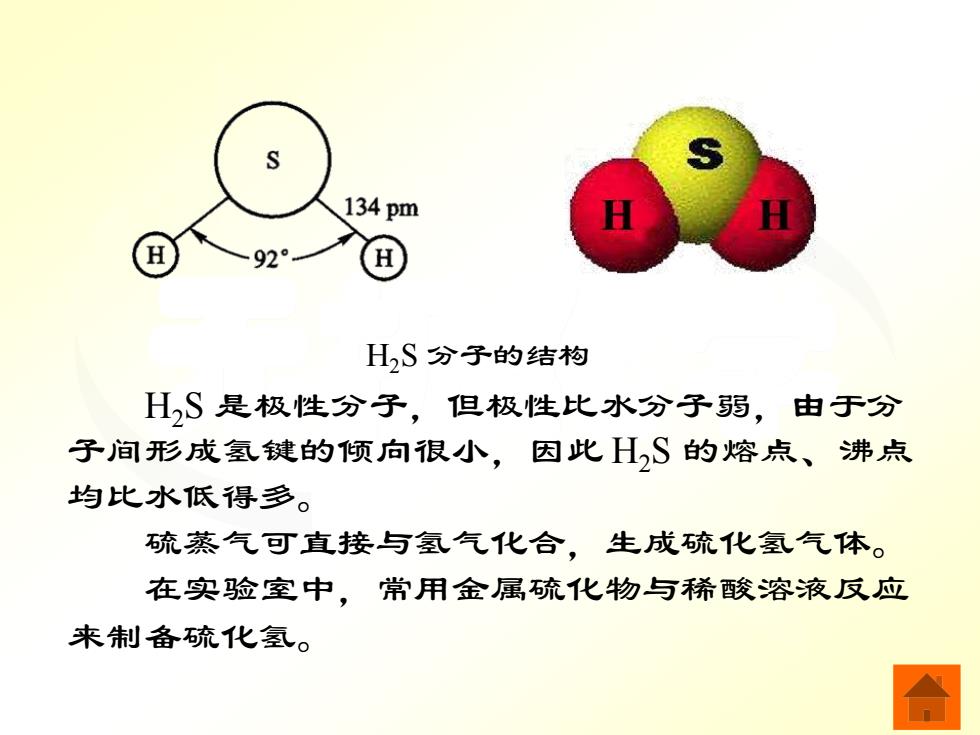
S 134pm 92° HS分子的结构 HS是极性分子,但极性比水分子弱,由于分 子间形成氢键的倾向很小,因此HS的熔点、沸点 均比水低得多。 硫蒸气可直接与氢气化合,生成硫化氢气体。 在实验室中,常用金属疏化物与稀酸溶液反应 来制备硫化氢
无机化学 H2S 分子的结构 H2S 是极性分子,但极性比水分子弱,由于分 子间形成氢键的倾向很小,因此 H2S 的熔点、沸点 均比水低得多。 硫蒸气可直接与氢气化合,生成硫化氢气体。 在实验室中,常用金属硫化物与稀酸溶液反应 来制备硫化氢

硫化氢的化学性质,主要有以下两个方面: (1)弱酸性:在常温下,1L水能溶解2.6L H)S气体,所得饱和溶液的浓度为0.1molL1。 硫化氢水溶液称为氢硫酸,它是一种二元弱酸。 (2)还原性:硫化氢具有较强的还原性。干 燥疏化氢在室温下不与空气中的氧气发生反应, 但点燃时能在空气中燃烧。氢硫酸的还原性比硫 化氢气体强,它在常温下可被空气中的O,氧化。 在酸性溶液中,许多氧化剂可氧化氢硫酸, 且一般氧化产物为单质硫。但当氧化剂的氧化性 很强且过量时,可将氢疏酸氧化成高氧化值的化 合物
无机化学 硫化氢的化学性质,主要有以下两个方面: (1) 弱酸性:在常温下,1 L 水能溶解 2.6 L H2S 气体,所得饱和溶液的浓度为 0.1 mol·L-1 。 硫化氢水溶液称为氢硫酸,它是一种二元弱酸。 (2) 还原性:硫化氢具有较强的还原性。干 燥硫化氢在室温下不与空气中的氧气发生反应, 但点燃时能在空气中燃烧。氢硫酸的还原性比硫 化氢气体强,它在常温下可被空气中的 O2 氧化。 在酸性溶液中,许多氧化剂可氧化氢硫酸, 且一般氧化产物为单质硫。但当氧化剂的氧化性 很强且过量时,可将氢硫酸氧化成高氧化值的化 合物

2.金属硫化物 氢硫酸是二元酸,有酸式盐和正盐两种类型 的盐。氢硫酸的酸式盐均易溶于水;氢硫酸的正 盐中,碱金属的硫化物和BS易溶于水,碱土金 属硫化物微溶于水(BS难溶),其他金属的硫化 物大多难溶于水,有些还难溶于酸,且多数具有 特征的颜色。 合
无机化学 2. 金属硫化物 氢硫酸是二元酸,有酸式盐和正盐两种类型 的盐。氢硫酸的酸式盐均易溶于水;氢硫酸的正 盐中,碱金属的硫化物和 BaS 易溶于水,碱土金 属硫化物微溶于水 (BeS 难溶),其他金属的硫化 物大多难溶于水,有些还难溶于酸,且多数具有 特征的颜色