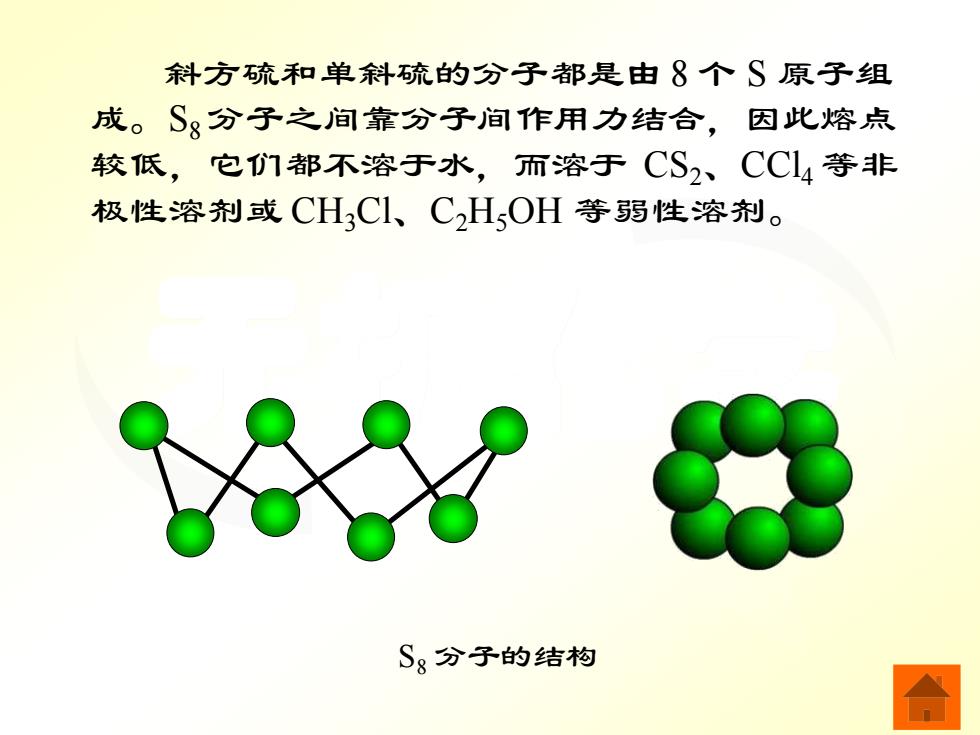
斜方硫和单斜硫的分子都是由8个S原子组 成。S分子之间靠分子间作用力结合,因此熔点 较低,它们都不溶于水,而溶于CS2、CC4等非 极性溶剂或CH,Cl、C,HOH等弱性溶剂。 Sg分子的结构
无机化学 S8 分子的结构 斜方硫和单斜硫的分子都是由 8 个 S 原子组 成。S8 分子之间靠分子间作用力结合,因此熔点 较低,它们都不溶于水,而溶于 CS2、CCl4 等非 极性溶剂或 CH3Cl、C2H5OH 等弱性溶剂

疏的化学性质比较活泼,能与许多金属直接化 合,也能与氢气、氧气、卤素单质(除碘外)、炭、 磷等直接作用。当硫与金属、氢、炭等还原性较强 的物质作用时,表现出氧化性。 当硫与电负性比它大的非金属元素化合时,则 表现出还原性。 硫能与具有氧化性的酸反应: S+6HNO,△H,SO,+6NO2↑+2H20 硫在热碱溶液中发生歧化反应: 3S +6NaOHA 2Na,S Na,SO,+3H2O
无机化学 硫的化学性质比较活泼,能与许多金属直接化 合,也能与氢气、氧气、卤素单质(除碘外)、炭、 磷等直接作用。当硫与金属、氢、炭等还原性较强 的物质作用时,表现出氧化性。 当硫与电负性比它大的非金属元素化合时,则 表现出还原性。 硫能与具有氧化性的酸反应: S + 6HNO H SO + 6NO + 2H O 3 2 4 2 2 △ ↑ 2 2 3 2 3S + 6NaOH 2Na S + Na SO + 3H O △ 硫在热碱溶液中发生歧化反应:
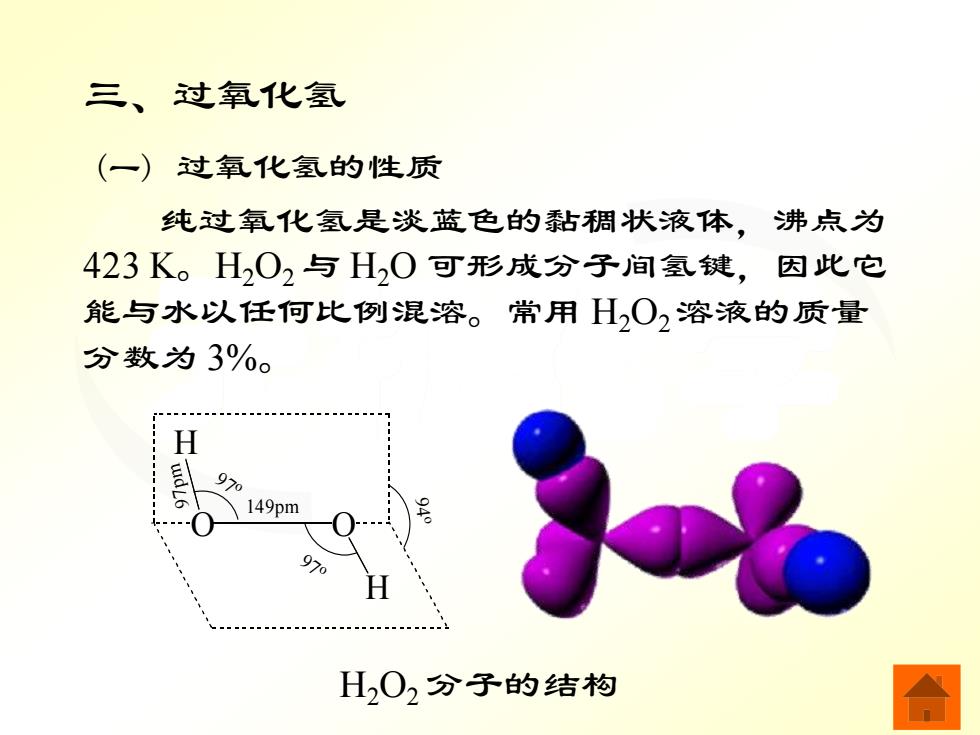
三、过氧化氢 (一)过氧化氢的性质 纯过氧化氢是淡蓝色的黏稠状液体,沸点为 423K。H202与H20可形成分子间氢键,因此它 能与水以任何比例混溶。常用H,O,溶液的质量 分数为3%。 H 97 149pm 970 H02分子的结构
无机化学 三、过氧化氢 (一) 过氧化氢的性质 纯过氧化氢是淡蓝色的黏稠状液体,沸点为 423 K。H2O2 与 H2O 可形成分子间氢键,因此它 能与水以任何比例混溶。常用 H2O2 溶液的质量 分数为 3%。 O O H H 149pm 97 o 97 o 97pm 94 o H2O2 分子的结构

1.不稳定性 纯HO,在低温下是比较稳定的,分解作用比 较缓慢。受热、光照或加入少量酸、碱时,H202 分解速率加快: 2H202(①)=2H20)+02(g) H,O,分解反应为歧化反应,少量Fe2+、Mn2+ 等金属离子的存在能加速H02的分解。市售双氧 水中常加入焦磷酸钠等物质作稳定剂,保存H02 溶液时应注意避光、低温和密封
无机化学 2 2 2 2 2H O (l) 2H O(l) + O (g) H2O2 分解反应为歧化反应,少量 Fe2+ 、Mn2+ 等金属离子的存在能加速 H2O2 的分解。市售双氧 水中常加入焦磷酸钠等物质作稳定剂,保存 H2O2 溶液时应注意避光、低温和密封。 1. 不稳定性 纯 H2O2 在低温下是比较稳定的,分解作用比 较缓慢。受热、光照或加入少量酸、碱时,H2O2 分解速率加快:

2.弱酸性 过氧化氢是一种极弱的酸,其酸性比水略强。 HO,能与某些金属氢氧化物反应,生成过氧化物 和水。 3.氧化还原性 H2O2既有氧化性,又有还原性。H202在酸性 溶液或碱性溶液中,一般表现出强氧化性。 H02的还原性比较弱,只有当它与强氧化剂 作用时才显示出来
无机化学 3. 氧化还原性 H2O2 既有氧化性,又有还原性。H2O2 在酸性 溶液或碱性溶液中,一般表现出强氧化性。 H2O2 的还原性比较弱,只有当它与强氧化剂 作用时才显示出来。 2. 弱酸性 过氧化氢是一种极弱的酸,其酸性比水略强。 H2O2 能与某些金属氢氧化物反应,生成过氧化物 和水