
10.11 催化反应动力学 ·一、催化反应原理: ·催化剂:可明显改变化学反应速率,而本身在反应 前后的化学性质和数量均不发生变化的物质。 ·这种作用称为催化作用。 催化剂只能改变反应速率(即达到平衡的速率), 而不能改变反应平衡。 ·催化剂对于正向和逆向反应具有相同的催化作用。 ·催化剂有正催化剂(加速)和负催化剂(减速)。 减速者又称为阻化剂
10.11 催化反应动力学 • 一、催化反应原理: • 催化剂:可明显改变化学反应速率,而本身在反应 前后的化学性质和数量均不发生变化的物质。 • 这种作用称为催化作用。 • 催化剂只能改变反应速率(即达到平衡的速率), 而不能改变反应平衡。 • 催化剂对于正向和逆向反应具有相同的催化作用。 • 催化剂有正催化剂(加速)和负催化剂(减速)。 减速者又称为阻化剂

「气相 均相催化:液相 催化反应: 多相底化:气液、国 气、固 了常见的几种重要催化反应: 硫酸工业:S02+1V202V,0s,S0, 氮肥工业:】 N2+3H2-Fe 2NHg C0+H0→ C02+H2 硝酸工业: NH3+02 -Pt. H,O+NO, 光合作用: 啤酒发酵、等等
常见的几种重要催化反应: 光合作用: 啤酒发酵、等等 硫酸工业: SO2 + 1/2O2 SO3 V2O5 氮肥工业: N2 + 3H2 2NH3 CO + H2O CO2 + H2 Fe 硝酸工业: NH3 + O2 H2O + NO2 Pt 气相 液相 气、固 液、固 催化反应: 均相催化: 多相催化:

催化反应机理 A+BK→AB A+K之AK AK+Bk店→AB+K .kcCAC k2 E。=E,+E3-E2
K A B AB + ⎯⎯→ 1 2 k k A K AK + ⎯⎯ ⎯⎯→3 k AK B AB K + ⎯⎯→ + 1 3 2 K A B k r k c c c k = E E E E a = + − 1 3 2 催化反应机理
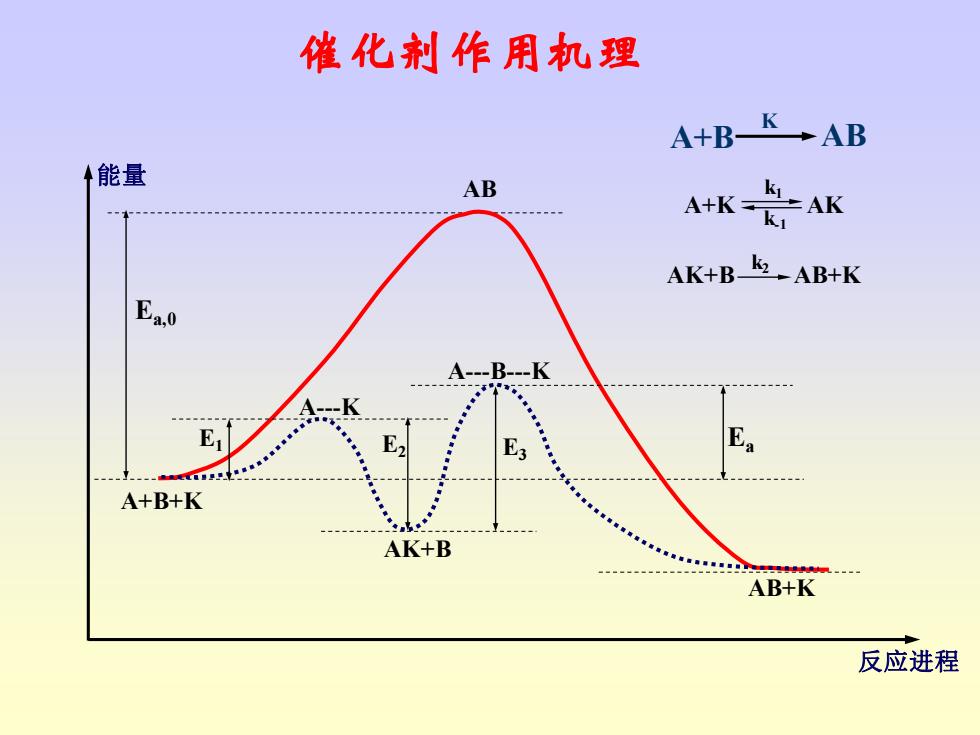
催化剂作用机理 A+B-K-AB 能量 AB AK是K AK+Bk-AB+K Ea.0 E A+B+K AK+B AB+K 反应进程
AB A+B+K AB+K Ea,0 E2 AK+B A-B-K A-K E1 E3 Ea 反应进程 能量 催化剂作用机理 A+B AB K A+K AK AK+B AB+K k2 k1 k-1

催化反应机理 催化作用的关键是大大降低了反应的活化能。 。如: (1) 2S02+02→S03 E =251 kJ/mol Pt催化: Ea’=62.8kJ/mol (2) 3H2+N2→2NH3 E=334.7 kJ/mol Fe-Al2O3-K2O: E3’=167.4kJ/mol
• 如: (1) 2SO2 + O2 → SO3 Ea = 251 kJ/mol Pt催化: Ea ’ = 62.8 kJ/mol (2) 3H2 + N2 → 2NH3 Ea = 334.7 kJ/mol Fe- Al2O3 -K2O: Ea ’ = 167.4 kJ/mol 催化作用的关键是大大降低了反应的活化能。 催化反应机理