
物理化学 第十二章不可逆电极过程
物 理 化 学 第十二章 不可逆电极过程
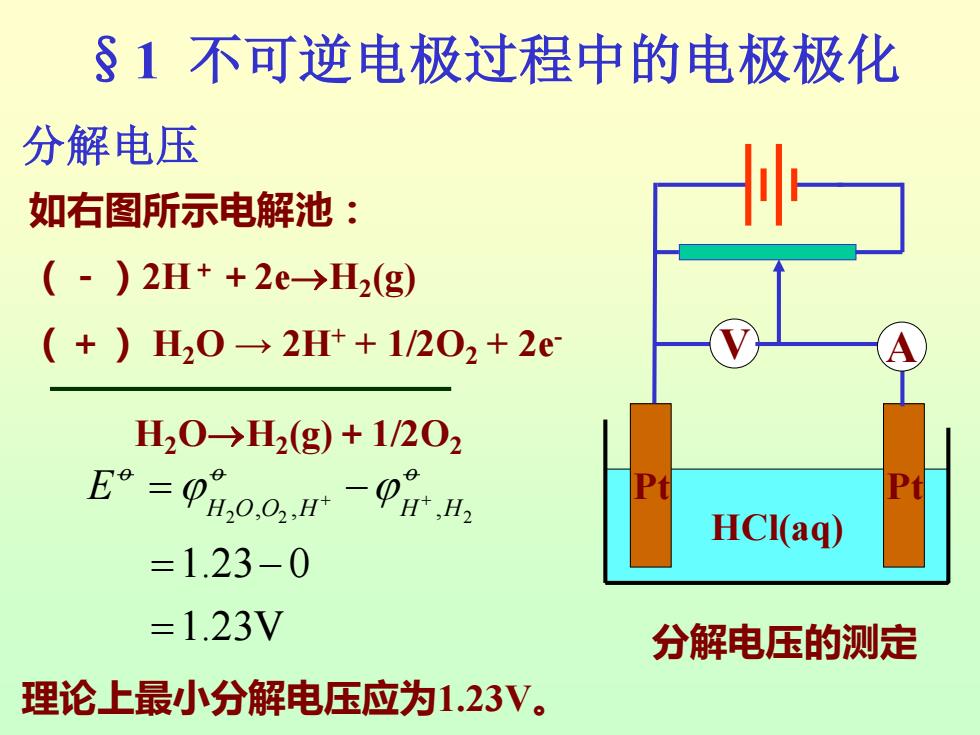
§1不可逆电极过程中的电极极化 分解电压 如右图所示电解池: (-)2H++2e→H2(g) (+)H20→2Ht+1/202+2e H20→H2(g)+1/202 E°=0日0.0,H-0H,4 P1 HCI(aq) =1.23-0 =1.23V 分解电压的测定 理论上最小分解电压应为1.23V
§1 不可逆电极过程中的电极极化 如右图所示电解池: (-)2H++2e→H2 (g) (+) H2O → 2H+ + 1/2O2 + 2e- 分解电压 H2O→H2 (g)+1/2O2 2 2 2 , , , 1.23 0 1.23V o o o H O O H H H E = − + + = − = HCl(aq) Pt Pt V A 分解电压的测定 理论上最小分解电压应为1.23V
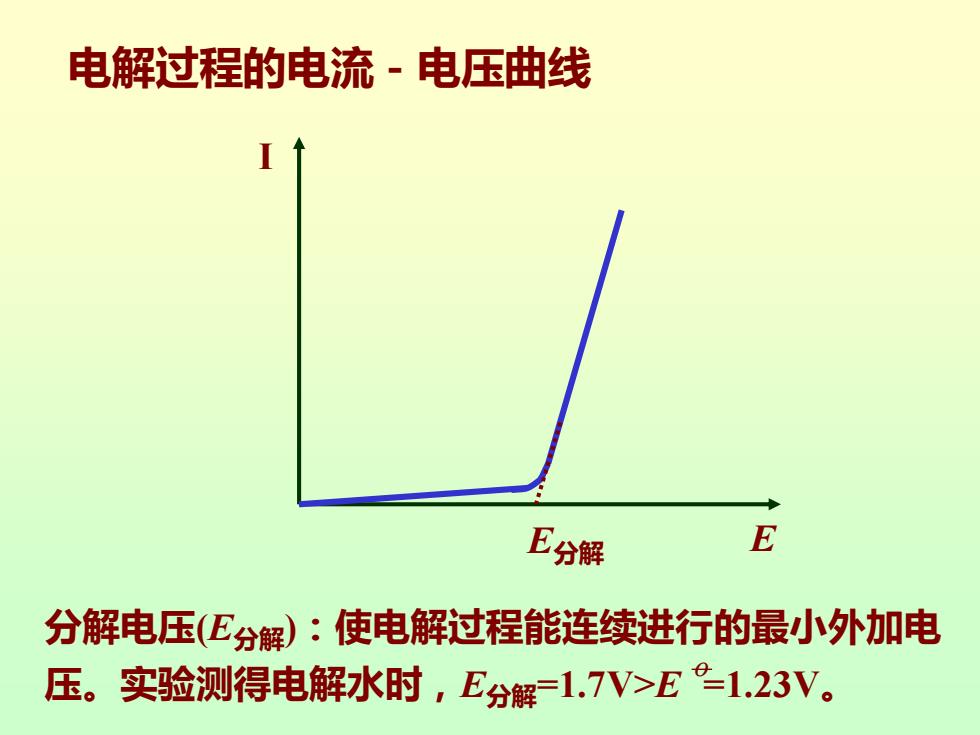
电解过程的电流-电压曲线 E分解 E 分解电压(E分解):使电解过程能连续进行的最小外加电 压。实验测得电解水时,E分解=1.7V>E°1.23V
I E分解 E 电解过程的电流-电压曲线 分解电压(E分解):使电解过程能连续进行的最小外加电 压。实验测得电解水时,E分解=1.7V>E =1.23V。 o
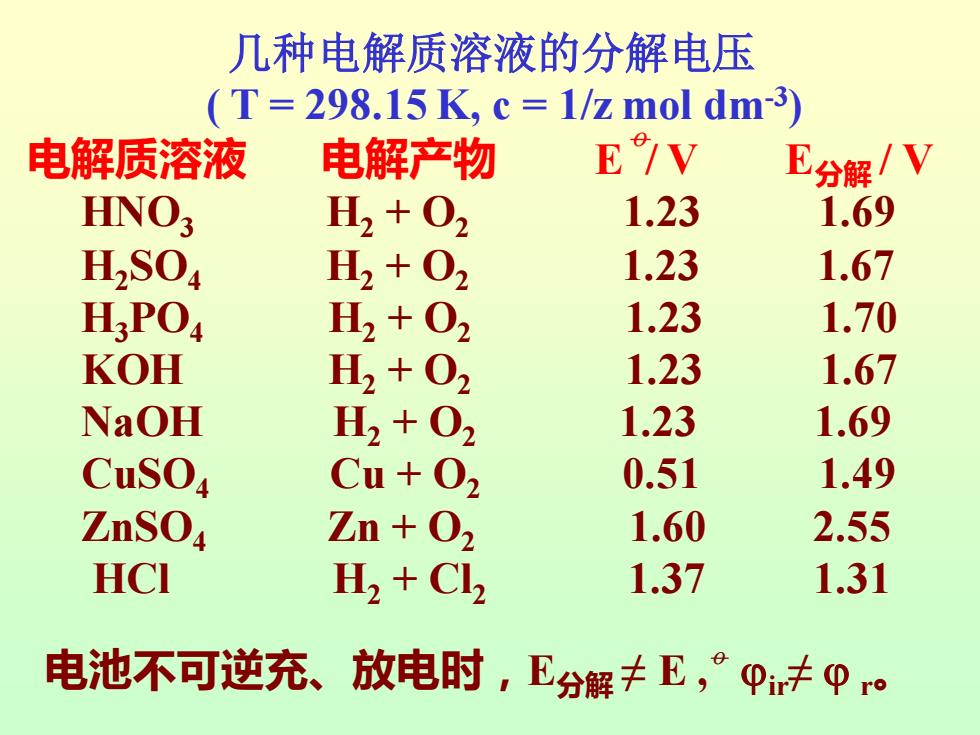
几种电解质溶液的分解电压 (T=298.15K,c=1/z mol dm-3) 电解质溶液 电解产物 E/V E分解/V HNO3 H2+02 1.23 1.69 H2S04 H2+02 1.23 1.67 H3P04 H2+02 1.23 1.70 KOH H2+02 1.23 1.67 NaOH H2+02 1.23 1.69 CuSO4 Cu+02 0.51 1.49 ZnSO4 Zn + 02 1.60 2.55 HCI 1.37 1.31 电池不可逆充、 放电时,E分解丰E,°p未0ro
几种电解质溶液的分解电压 ( T = 298.15 K, c = 1/z mol dm-3 ) 电解质溶液 电解产物 E / V E分解 / V HNO3 H2 + O2 1.23 1.69 H2SO4 H2 + O2 1.23 1.67 H3PO4 H2 + O2 1.23 1.70 KOH H2 + O2 1.23 1.67 NaOH H2 + O2 1.23 1.69 CuSO4 Cu + O2 0.51 1.49 ZnSO4 Zn + O2 1.60 2.55 HCl H2 + Cl2 1.37 1.31 o 电池不可逆充、放电时,E分解 ≠ E , o ir≠ r

极化作用和超电势 电解通常是在不可逆的情况下进行的,分解电压常常 大于理论分解电压。有电流通过电极时,电极电势偏 离平衡值的现象,称为电极的极化作用 (Polarization)。采用超电势(Overpotential)定量描 述电极极化的程度,符号为7。 定义: n=p.-0, 仰r、:不可逆充、放电时的电极电势; φ。:平衡电极电势
电解通常是在不可逆的情况下进行的,分解电压常常 大于理论分解电压。有电流通过电极时,电极电势偏 离平衡值的现象 , 称为电极的 极化作用 (Polarization)。采用超电势(Overpotential)定量描 述电极极化的程度,符号为。 定义: = − ir r ir、:不可逆充、放电时的电极电势; r : 平衡电极电势。 极化作用和超电势