
第二章热力学第一定律·29·[16. 144 × 8. 314 5 × (149. 27 298)] J =- 66. 55 kJPIWs =2000kPa1.3 - 1Q=AU-W.=(-29.95+66.55)kJ=36.6kJ三种体积功的示意图如图2-1所示。(1)是等温可逆膨胀过程,(2)是绝热可逆膨胀过程,(3)是多方可逆膨胀过程。三条曲线100kPa(2)?(3):(1):下的面积即是系统所做的功。由计算结果可知一W,一W>0V-W2.图2-123.1mol单原子理想气体从始态298K、200kPa,经下列途径使其体积加倍,试计算每种途径的终态压力及各过程的Q、W和△U。画出p-V示意图,并把AU和W值按大小次序排列。(1)等温可逆膨胀;(2)绝热可逆膨胀;(3)沿着p/Pa=1.0×10*Vm/(dm2·mol-1)+b的途径可逆变化。解(1)等温可逆膨胀AU,=0V.2VWi=-nRTIn1×8.3145×298×lnVJ=-1717JQ, = -W,=1 717 JVi_200 kPa .Vi=100 kPa终态压力P2=Va2V.(2)绝热可逆膨胀5R/25单原子理想气体3R/2-3Cv.m298X终态温度T2=TK-187.7K2V,-V..终态压力200000XPa=63.0kPap2=pl2VAU,= nCv.m(Tz-T)= [1×1.5× 8.314 5× (187.7-298)IJ= -—1376JQ2 = 0W,AUz—Q2=-1376J(3)沿着p/Pa=1.0×10*Vm/(dm2.mol-1)+b的途径可逆变化nRT=12.39dm2始态n=1mol,T=298K,p=200kPa,Vj=Pi终态体积Vz=2Vi=24.78dm3将始态压力、体积代人p/Pa=1.0×10Vm/(dm.mol-1)+b,得200000=1.0X10×12.39+b解得b=76100终态压力p2=(1.0×10*×24.78+76100)Pa=323.9kPaT,=PV-1323900×24.78X10~K=965.33KnR1X8.3145△U=nCy.m(TzT)=[1×1.5×8.3145×(965.33-298)JJ=8322.8J*(1. 0 × 10v + b)dvWs-bdV-

.30.物理化学辅导与习题详解I × 1. 0 × 10* × (V - V) + b× (V, - Vi)=[ 号× 1. 0 × 10* × (24. 78 = 12. 39*) × 10-3 + 76 100 × (24. 78 - 12. 39) × 10-23245.56JQ=U-W=(8322.8+3245.56)J=1.16X10J系统始态压力为200kPa,体积为V1,三种过程终态体积均为p/kPal(3)3002V1,终态压力分别是100kPa(等温可逆膨胀)、63.0kPa(绝热可逆膨胀)和323.9kPa(沿p/Pa=1.0×10*Vm/(dmmol-1)+6可逆200变化)。在p-V图上画出的三种体积功示意图如图2-2所示,三条曲100(1)线下的面积即是系统所做的功。由图可知一W>一W,>一Wz。三(2)种过程热力学能变的大小次序为AU.>AU,>△U2。10V.202V/30V/(dm3. mol-1)24.某热机的低温热源的温度为313K,若高温热源分别为:(1)373K(在大气压力下水的沸点);(2)538K(在压力为5.0.×10图2-2Pa下水的沸点)。试分别计算该热机的理论转换系数。-WT-T.解热机的效率n=QnTTh-T_373-313=16. 1%(1) n=Th373Th-T-538-313(2)7一=41.8%Th53825.某电冰箱内的温度为273K,室温为298K,今欲使1kg273K的水变成冰,最少需做功多少?已知273K时冰的熔化热为335kJ·kg-1。解将冰箱看做理想的致冷机,冷冻系数T1273β==10.92T- T298-273系统从低温热源(1kg273K的水)吸取热量Q'i=335kJW=%-335kj最少需对系统做功30.68kJ-10.9226.有如下反应,设都在298K和大气压力下进行,请比较各个反应的△U和△H的大小,并说明这种差别主要是由什么因素造成的。(1)C12H22Ou(蔗糖)完全燃烧;(2)CioH(萘,s)完全氧化为苯二甲酸CH(COOH)2(s);(3)乙醇的完全燃烧;(4)PbS(s)完全氧化成PbO(s)和SOz(s)。解AH=AU+△nRT完全燃烧12CO:(g)+11H,0()(1) C1HzOu(s)+120,(g)An = 12 -12 = 0, AH = AU完全氧化=5C,H,(COOH);(s)+H,O(1)(2)4C1oHg(s)+10.502(g)An = 0 —10. 5=-10. 5,2AH<AU完全燃烧(3)C,H,OH(1)+302(g)=2CO,(g)+3H,0(1)△n -2-3=-1,AH < AU完全氧化-PbO(s)+SO2(g)(4)PbS(s)+1. 50z(g)

.31.第二章热力学第一定律An = 1 - 1. 5 =- 0. 5, AH <AUAU和△H的差别主要是由反应前后气态物质的物质的量不同而引起的。如果反应前后气态物质的物质的量相同,即△n=0,则△H=△U;如果不相同,当△n<0时△H<AU,当An>0时AH>AU.27.0.500g正庚烷放在弹式量热计中,燃烧后温度升高2.94K,若量热计本身及其附件的热容量为8.177kJ·K~1,计算298K时正庚烷的摩尔燃烧熔(量热计的平均温度为298K)。解正庚烷的燃烧反应为C,H/(1)+110z(g)—7CO2(g)+8H,0(1)0.500g正庚烷燃烧反应的反应进度0.500 g△n(正庚烷)一m/M(正庚烷)==4.99×10-3mol100.2g·mol-1=(正庚烷)1在弹式量热计中测得的等容燃烧热—8.177 × 2. 94)QA.U.kJ . mol-1 = -- 4.818 × 103 kJ .mol-1AS4.99X10正庚烷的摩尔燃烧烩AHm=AU.+ART=[-4.818×10+(7-11)×8.3145×2981J.mol-1=-4.828×103kJ.mol-128.根据下列反应在298.15K时的恰变值,计算AgCI(s)的标准摩尔生成焰A/He(AgCl,s,298.15K)。(1) Ag20(s)+2HCl(g)2AgCl(s)+H20(1),A,H(298.15K)=—324. 9kJ ·mo1-1(2) 2Ag(s)+号O,(g)Ag20(s),A,H.,(298. 15 K)= - 30. 57 kJ · mol-1→H,(g)+号Cl (g)HCl(g),A,H(298. 15 K)=—92. 31 kJ · mol-1(3)-O2(g)-H,O(1),A,H(298. 15 K)285. 84 kJ · mol-1(4) H2(g)+-解由上述四个反应组合()×+(2)×+(3)(4)×22即可得到AgCl(s)的生成反应Cl2(g) AgCl(s)Ag(s) +所以LAHeAH@ (AgCl,s,298.15 K)=AHe+AH+AH2×(285. 84)]×(—30. 57)+(—92. 31)—X(-324. 9)+-kJ · mol-22=-127.13kJ.mol-129.在298.15K及100kPa压力时,设环丙烷、石墨及氢的燃烧焰△H(298.15K)分别为—2092kJ?mol-1、-393.8kJ·mol-1及-285.84kJ·mol-1。若已知丙烯C,H(g)的标准摩尔生成焰△/H=20.50kJ·mol-1,试求:(1)环丙烷的标准摩尔生成恰A;H(298.15K);(2)环丙烷异构化为丙烯的摩尔反应恰变值△,H.e(298.15K)。解(1)环丙烷的生成反应为3C(石墨)+3H2(g)—CH(g)

.32.物理化学辅导与习题详解环丙烷的生成恰即上述生成反应的反应熔AH-3AH(石墨)+3AH(Hzg)-AH(CHg)=[3×(—393.8)+3×(—285.84)-(-2092)JkJ-mol-1=53.08kJ.mol-1(2)环丙烷异构化为丙烯的反应为H,CCHz CH,CH -CH2CH2环丙烷异构化为丙烯的反应焰AHH(丙烯)-(环丙烷)= (20.50- 53.08) kJ .mol-1=-32.58 kJ .mol-130.根据以下数据,计算乙酸乙酯的标准摩尔生成恰AH(CHCOOC,Hs,,298.15K)。CHCOOH(1)+C,H,OH(1)-CH,COOC,H,(1)+H,O(1),A,H(298.15K)=-9.20kJ ·mol-1乙酸和乙醇的标准摩尔燃烧焰△H(298.15K)分别为-874.54kJ·mol-1和-1366kJ·mol-1,COz(g)和H,O(1I)的标准摩尔生成恰分别为-393.51kJ·mol-1和-285.83kJ.mol-1解 CH,COOH(I)+C,H,OH(1)—CHCOOC,Hs(1)+H,O(1)A,H(298.15K)=A.H(CHCOOH,1)+AH(CHOH,1)AH(CHCOOC,H,)-4H(HO,1)乙酸乙酯的标准摩尔燃烧焰为A.H(CH,COOC,H,,1)=AH(CH,COOH,1)+A.He(C,H,OH,1)-AH(H,O,1)-H(298.15K)=(—874.541366+0+9.20)kJ.mol-1=-2231.34kJ·mol-1乙酸乙酯的燃烧反应为CH,CO0OC,H,(1)+ 5O2(g)4CO2(g)+4H,0(1)A,H(298.15K)=4AH (CO2,g)+4AH.(H20,1)—A/H(CH,COOC,Hs,1)—5A,H (O2+g)乙酸乙酯的标准摩尔燃烧饸是乙酸乙酯燃烧反应的反应焰,即△He(298.15K)=4H(CH,COOC,Hs,1),所以A,He (CH.COOC,Hs,l)=4AH (CO2g)+4AH(H2O,1)-5A,H(O2g)-A.H(CH.CO0C,Hs,1)=[4×(—393.51)+4×(-285.83)-0(—2231.34)]kJ·mol-1=-486.02kJ.mol-131.请计算298K和标准压力下,如下反应的标准摩尔恰变△,H(298.15K),这个数值的1/4称为C一H键的“键熔”(平均值)。C(g) + 4H(g) CH,(g)已知:石墨升华为碳原子的变估计为AsubH=711.1kJmol-,Hz(g)-—2H(g)的标准解离恰AaH=431.7kJ·mol-1,CH(g)的标准摩尔生成恰ArH(298.15K)=-74.78kJ·mol-l。解 ①C(石墨)—C(g),AsubH=711.1kJ·mol-1②H2(g)-2H(g),AdiaH=431.7kJ .mol-1
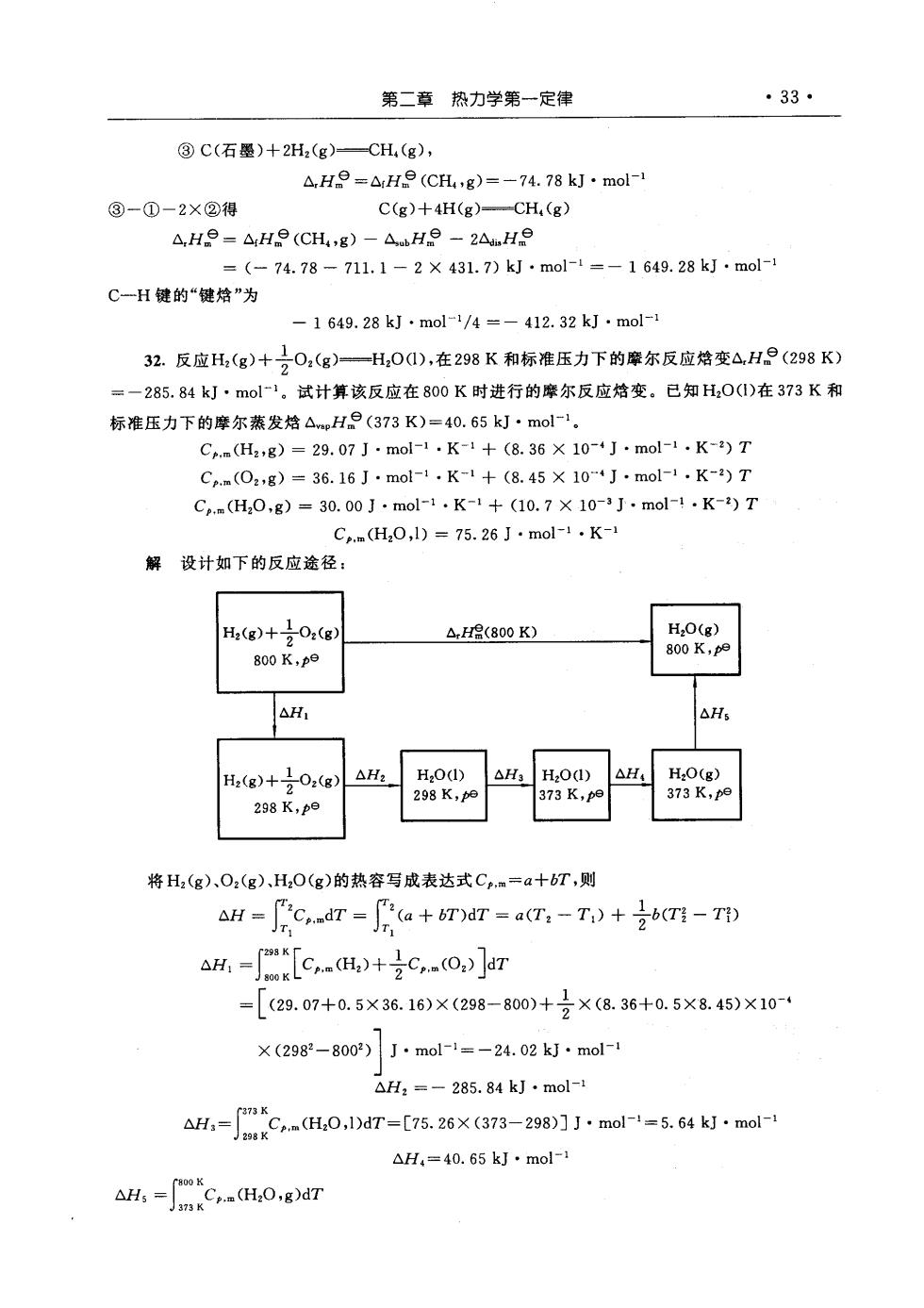
·33·第二章热力学第一定律③C(石墨)+2Hz(g)-CH(g),A,H.ArHe (CH4,g)=—74. 78 kJ · mol-1③-①-2×②得C(g)+4H(g)CH,(g)AHe-AHe(CH,g)-AbHe-2AHe= (74.78-711.1-2× 431.7)kJ ·mol-l=—1649.28kJ.mol-1C--H键的“键恰"为1649.28kJ·mol-1/4=—412.32kJ.mol-132.反应H,(g)+O,(g)———H,O(),在298K和标准压力下的摩尔反应恰变△,H(298K)-285.84kJ·mol=1。试计算该反应在800K时进行的摩尔反应恰变。已知H2O(1)在373K和标准压力下的摩尔蒸发焰ApH(373K)=40.65kJ·mol-1。Cp.m(H2,g) = 29. 07 J -mol-1 . K-1 + (8. 36 × 10-4J -mol-1 .K-2) TCp.m(O2,g) = 36.16 J ·mol-1.K-1 + (8. 45 × 10"4J .mol-1 .K-2) TCp.m(H2O,g) = 30. 00 J .mol-1 .K-1 + (10.7 X 10-3 J - mol-1 .K-2) TCpm(H,0,1) = 75.26 J ·mol-1 .K-1解设计如下的反应途径:H,O(g)H2(g)+02(g)H(800K)800 K,pe800K,poAHAHsH,O(g)H,0(1)AH4AH2AH3H,O(1)Hz(g)-Oz(g)373 K,pe298K,po373 K,pe298 K,pe将H2(g)、O2(g))、H2O(g)的热容写成表达式Cpm=a+bT,则.mdT(a + bT)dT = a(T, - T) +AHb(T -T)Cp.m(O2) [dTCem(H2)+AHI0(29.07+0.5×36.16)×(298—800)+X(8.36+0.5X8.45)X10-4X(2982—8002)J ·mol-1=-24. 02 kJ ·mol-1△Hz=-285.84kJ .mol-1,m(H,0,1)dT=[75.26X(373298)JJ·mol-1=5.64kJ·mol-1AH:AH,=40.65kJ.mol-1AHsCp.m(H2O,g)dT