
即 © s 将ES代入V=kES中,则有: k2[E]I[S] V=k地+S) 设K。=k-业,并设Vm=kE 则 v-长 V≈ S=KS,放V与S成直线关系。 K 底物浓度足够大时候,即S]>10OK时,则K+母≈[S],代入米氏方程式后: vv IS] V达到极限值V.如果底物浓度为中等数值,V不内,表现为曲线的弯曲 部分(见图42中的AB段)· 将保氏宽避行整理后,可得 K=S号-D 当酶促反应处于V=)V时,则 由此得知,K值是反v)达到最大反应速度心 ·半时的底物浓度(单 位为molL或nmol/L),这便是米氏常数的物理意义,这种关系可参看图4-2的OA段。米 氏常数是酶的特征常数,只与酶的性质有关,不受底物浓度和酶浓度的影响。不同酶K 值不同。可从手册中查得作用于不同底物时各种酶的K值,也可以根据测得的K来鉴别 酶.如脲酶的Km=25mmol/L,苹果酸酶K.=0.05mmol/L。各种酶的Km值在110-$~1molL 或更高一些的区间,大多数在103~105molL之间。Km值作为常数只是对一定的底物 定H值和一定温度条件而言。Km的大小近似地反映了醇与底物结合成中间产物的难易 上时所需店 物浓度也 这意 气底物 可的养 以催化几 发生 化物儿是的适底物 有 萄萄糖 知里 K值分别为1510molL和1.510mo 由此知,萄萄糖是糖溢的适底物】 111
111 即 [ES] = k1[Et][S] k―l +k2+k1[S] = [Et][S] k―l +k2 k1 +[S] 将[ES]代入V = k2[ES]中,则有: V = k2 [Et][S] k- ―l +k2 k1 +[S] 设Km = k -1+k2 k1 ,并设Vmax = k2[Et] 则 V = Vmax[S] Km+[S] 这就是著名的米氏方程,Km为米氏常数,它是酶的重要参数,是酶的特征性常数。 应用米氏方程可以圆满地说明图4-2中的V-[S]变化曲线。 底物浓度很低时,即[S]<0.01Km时,则Km +[S] ≈ Km,代入米氏公式后: V ≈ Vmax[S] Km = K[S],故V与[S]成直线关系。 底物浓度足够大时候,即[S] > 100Km时,则 Km + [S] ≈ [S],代入米氏方程式后: V ≈ Vmax[S] [S] ≈ Vmax V 达到极限值Vmax。如果底物浓度为中等数值,V∝ [S] Km + [S] ,表现为曲线的弯曲 部分(见图4-2中的AB段)。 (三)米氏常数 将米氏方程式进行整理后,可得: Km = [S]( Vmax V -1) 当酶促反应处于V= 1 2 Vmax时,则 Km = [S] 由此得知,Km值是反应速度(V)达到最大反应速度(Vmax)一半时的底物浓度(单 位为mol/L或mmol/L),这便是米氏常数的物理意义,这种关系可参看图4-2的OA段。米 氏常数是酶的特征常数,只与酶的性质有关,不受底物浓度和酶浓度的影响。不同酶Km 值不同。可从手册中查得作用于不同底物时各种酶的Km值,也可以根据测得的Km来鉴别 酶。如脲酶的Km=25mmol/L,苹果酸酶Km=0.05mmol/L。各种酶的Km值在1 10 -8~1mol/L 或更高一些的区间,大多数在10 -3~10 -5 mol/L之间。Km值作为常数只是对一定的底物、 一定pH值和一定温度条件而言。Km的大小近似地反映了酶与底物结合成中间产物的难易 程度。Km值大,表明达到Vmax的一半时所需底物浓度也大,这意味着酶与底物之间的亲 和力弱;反之,Km值小,则表明酶与底物的亲和力强。显然,最适底物与酶的亲和力最 大。如果一种酶可以催化几种底物发生反应,就必然对每一种底物,各有一个特定的Km 值,其中Km值最小的底物是该酶的最适底物。如葡萄糖和果糖都是己糖激酶的底物,其 Km值分别为1.5 10 -4 mol/L和1.5 10 -3 mol/L,由此可知,葡萄糖是己糖激酶的最适底物

(四)米氏方程与K值的应 可由 到Vm的百分数) 求出应当加入底物的合理浓度: 反过关他尖要求反位速度达到物 求出该 到的反应速度。 99%=Km+S] +99S]=100S 、一2过菜化气摩值为止高底物过氧化氧浓度为0L时,求在 将已知条作S及K代入米氏方程式中,为V=骨-器:器 推导得 =25=80%。即V=80%Vmx 由此可认为有80%的酶已与底物作用生成了中间产物,故过氧化氢酶在此时被底物饱 和的百分数为80% (五)米氏常数与Vm的求法 从酶的V-S]图上可以得到Vx,再从V可求得相应的S,即K值。但实际上即 为了 当 +b的宜线方程,然后用图解法求出K值。 这就是最常用的Lm T-Burk的双倒 数作图法(double-r ciprocal plot法)。 将米氏方程改写成以下形式:吉=冬司十之 实验时,选择不同的S]测定相应的V,求出两者的倒数,以对作图,绘出直线 其斜率为心。将直线延长与横轴相交,在横轴上的截距为一,这样,K就可以从 直线的载距上计算出来。直线在纵轴上的截距为、。此法方便而应用广泛,但也有缺 点,实验点过分集中于直线的左端,作图不易十分准确(见图43)。 图4-3双倒数作图法求K.与V 112
112 (四)米氏方程与Km值的应用 可由所要求的反应速度(应达到Vmax的百分数),求出应当加入底物的合理浓度; 反过来,也可以根据已知的底物浓度,求出该条件下可以达到的反应速度。 例1:如果要求反应速度达到Vmax的99%,其底物浓度应为: 99% = 100% [S] Km+[S] 99Km + 99[S] = 100[S] ∴ [S] = 99Km 例2:过氧化氢酶的Km值为25 mmol/L,当底物过氧化氢浓度为100 mmol/L时,求在 此底物浓度下过氧化氢酶被底物饱和的百分数。 将已知条件[S]及Km代入米氏方程式中,为:V = Vmax[S] Km+[S] = 100Vmax 25+100 = 100Vmax 125 推导得 V Vmax = 100 125 = 80%。即 V = 80%Vmax。 由此可认为有80%的酶已与底物作用生成了中间产物,故过氧化氢酶在此时被底物饱 和的百分数为80%。 (五)米氏常数与Vmax的求法 从酶的V-[S]图上可以得到Vmax,再从 1 2 Vmax可求得相应的[S],即Km值。但实际上即 使底物浓度很大,也只能得到趋近于Vmax的反应速度,而达不到真正的Vmax,因此测不到 准确的Km值。为了得到准确的Km值,可以把米氏方程的形式加以改变,使它成为相当于 y = ax + b的直线方程,然后用图解法求出Km值。这就是最常用的Lineweaver-Burk的双倒 数作图法(double-reciprocal plot 法)。 将米氏方程改写成以下形式: 1 V = Km Vmax 1 [S] + 1 Vmax 实验时,选择不同的[S]测定相应的V,求出两者的倒数,以 1 V 对 1 [S] 作图,绘出直线, 其斜率为 Km Vmax 。将直线延长与横轴相交,在横轴上的截距为- 1 Km ,这样,Km就可以从 直线的截距上计算出来。直线在纵轴上的截距为 1 Vmax 。此法方便而应用广泛,但也有缺 点,实验点过分集中于直线的左端,作图不易十分准确(见图4-3)。 图4-3 双倒数作图法求Km与Vmax
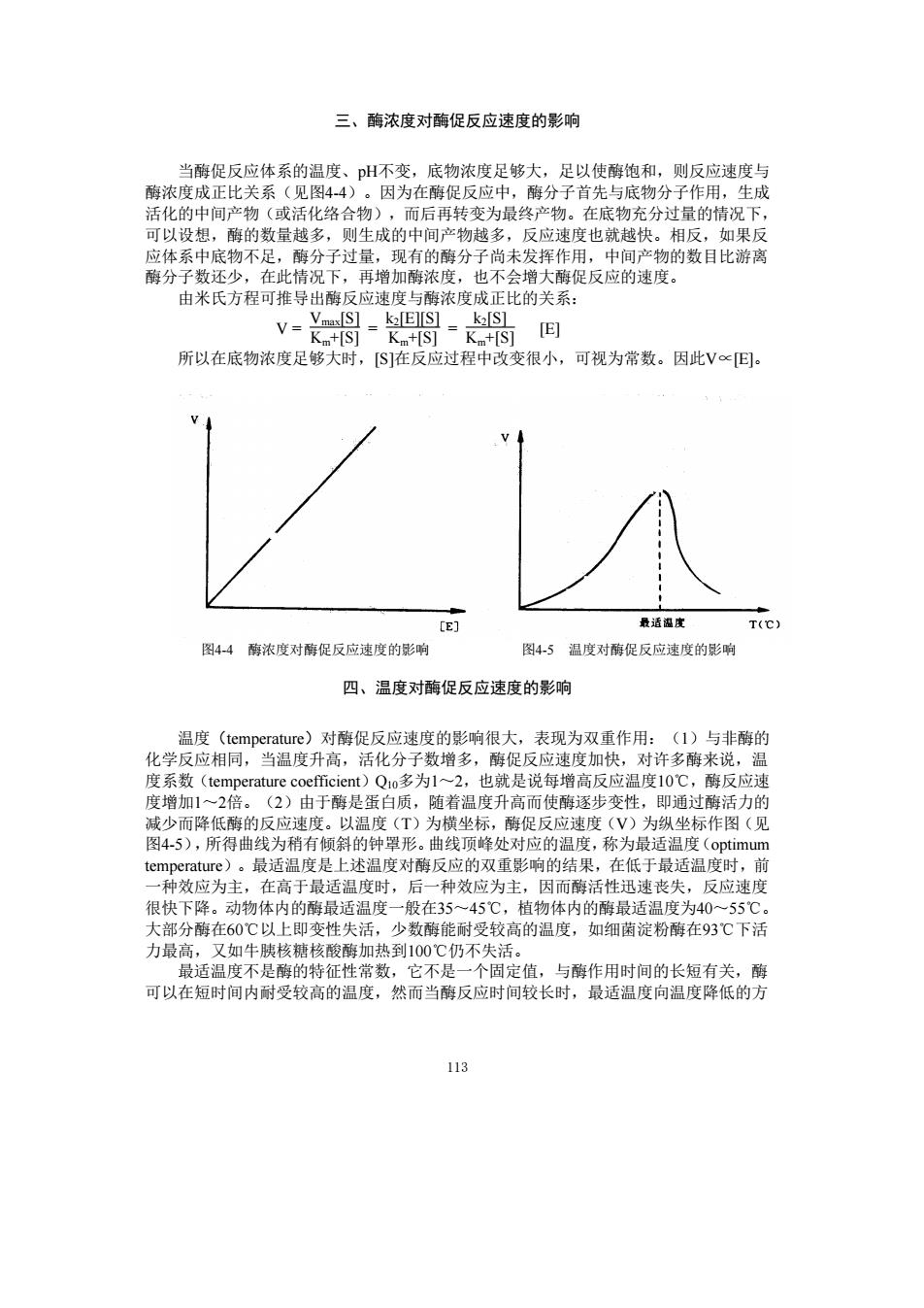
三、酶浓度对酶促反应速度的影响 当酶促反应体系的温度、pH不变,底物浓度足够大,足以使酶饱和,则反应速度与 酶浓度成正比关系(见图44)。因为在酶促反应中,酶分子首先与底物分子作用,生成 活化的中间产物(或活化络合物),而后再转变为最终产物。在底物充分过量的情况下 可以设想,酶的数量越多,则生成的中间产物越多,反应速度也就越快。相反,如果反 应体系中底物不足,酶分子过量,现有的酶分子尚未发挥作用,中间产物的数目比游离 酶分子数还少,在此情况下,再增加酶浓度,也不会增大酶促反应的速度。 由米氏方程可推导出酶反应速度与酶浓度成正比的关系: 所以在底物浓度足够大时,S在反应过程中改变很小,可视为常数。因此V∝回。 te) 最话湿皮 图44醇浓度对酶促反应速度的影响 图45温度对酶促反应速度的影响 四、温度对酶促反应速度的影响 化学反应相同,当 洱度(t 心)对酶促反应速度的影响很大,表现为双重作用 足反应速度 1)与非的 系 多为12,也就是说每增 许多降米 反应速 减少而降低酶的反应速度。以温度(T)为横坐标, 酶促反应速度(V)为纵坐标作图(见 图45),所得曲线为稍有倾斜的钟望形。曲线顶峰处对应的温度,称为最适温度(optimum temperature)。最适温度是上述温度对酶反应的双重影响的结果,在低于最适温度时,前 一种效应为主,在高于最适温度时,后一种效应为主,因而酶活性迅速丧失,反应速度 很快下降。动物体内的酶最适温度一般在35一45℃,植物体内的酶最适温度为40一55℃ 大部分朝在60℃以上 少数酶能耐受较高的温度,如细菌淀粉南在93℃下活 力最 适 牛胰核糖 热到100℃仍不为 可以在短时间内耐受较高的度 与酶作用时 《然反应时较长 的长有的 113
113 三、酶浓度对酶促反应速度的影响 当酶促反应体系的温度、pH不变,底物浓度足够大,足以使酶饱和,则反应速度与 酶浓度成正比关系(见图4-4)。因为在酶促反应中,酶分子首先与底物分子作用,生成 活化的中间产物(或活化络合物),而后再转变为最终产物。在底物充分过量的情况下, 可以设想,酶的数量越多,则生成的中间产物越多,反应速度也就越快。相反,如果反 应体系中底物不足,酶分子过量,现有的酶分子尚未发挥作用,中间产物的数目比游离 酶分子数还少,在此情况下,再增加酶浓度,也不会增大酶促反应的速度。 由米氏方程可推导出酶反应速度与酶浓度成正比的关系: V = Vmax[S] Km+[S] = k2[E][S] Km+[S] = k2[S] Km+[S] [E] 所以在底物浓度足够大时,[S]在反应过程中改变很小,可视为常数。因此V∝[E]。 图4-4 酶浓度对酶促反应速度的影响 图4-5 温度对酶促反应速度的影响 四、温度对酶促反应速度的影响 温度(temperature)对酶促反应速度的影响很大,表现为双重作用:(1)与非酶的 化学反应相同,当温度升高,活化分子数增多,酶促反应速度加快,对许多酶来说,温 度系数(temperature coefficient)Q10多为1~2,也就是说每增高反应温度10℃,酶反应速 度增加1~2倍。(2)由于酶是蛋白质,随着温度升高而使酶逐步变性,即通过酶活力的 减少而降低酶的反应速度。以温度(T)为横坐标,酶促反应速度(V)为纵坐标作图(见 图4-5),所得曲线为稍有倾斜的钟罩形。曲线顶峰处对应的温度,称为最适温度(optimum temperature)。最适温度是上述温度对酶反应的双重影响的结果,在低于最适温度时,前 一种效应为主,在高于最适温度时,后一种效应为主,因而酶活性迅速丧失,反应速度 很快下降。动物体内的酶最适温度一般在35~45℃,植物体内的酶最适温度为40~55℃。 大部分酶在60℃以上即变性失活,少数酶能耐受较高的温度,如细菌淀粉酶在93℃下活 力最高,又如牛胰核糖核酸酶加热到100℃仍不失活。 最适温度不是酶的特征性常数,它不是一个固定值,与酶作用时间的长短有关,酶 可以在短时间内耐受较高的温度,然而当酶反应时间较长时,最适温度向温度降低的方
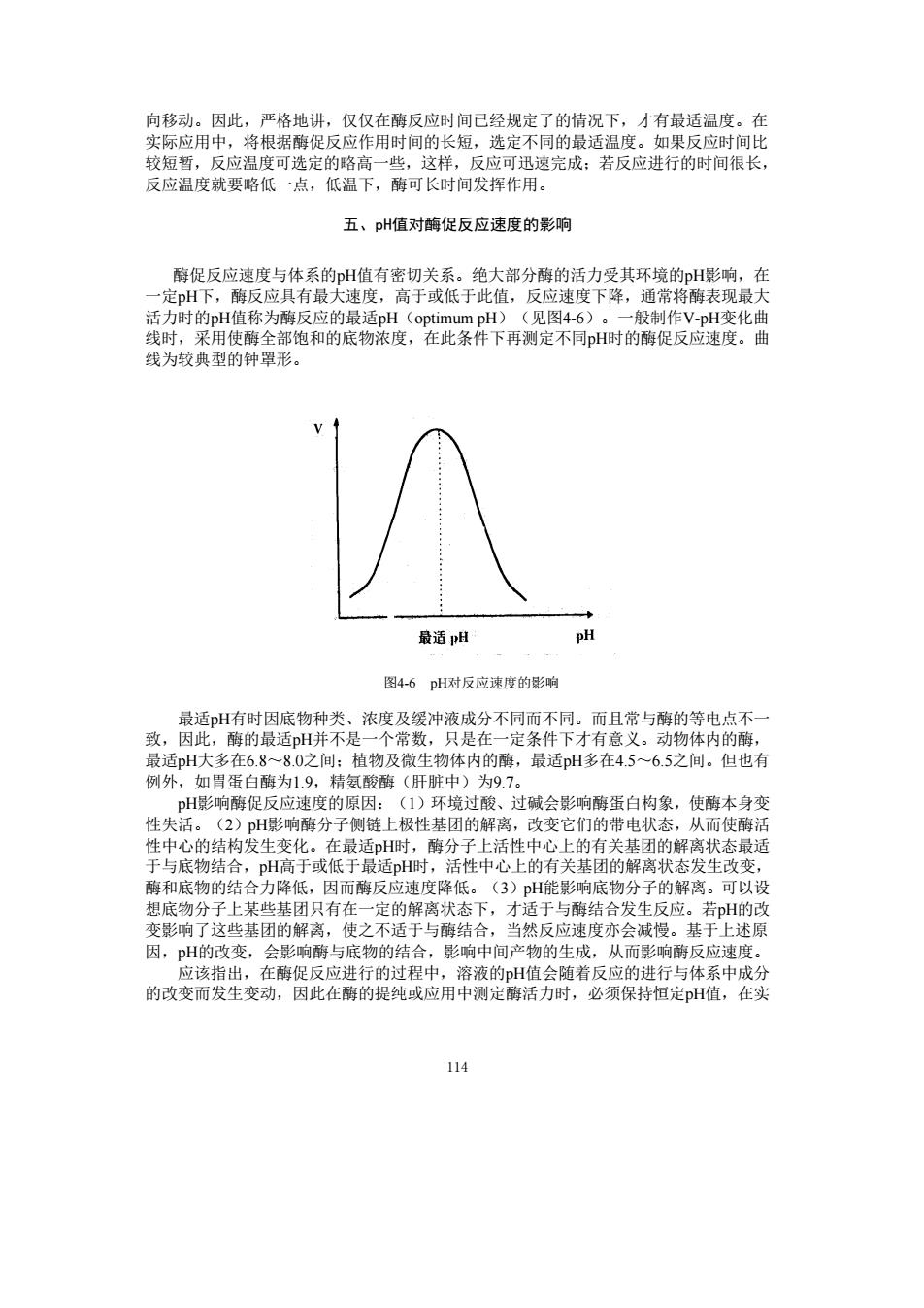
向移动。因此,严格地讲,仅仅在酶反应时间己经规定了的情况下,才有最适温度。在 用 作用的间的 如来 应 可选 速完成:若反应进行的时间很长 反应温度就要 一点 低温下,酶可长时 发挥作用。 五、pH值对酶促反应速度的影响 酶促反应 大部分酶的活力受其环境的H影响 在 H值称为 度下降, 时的 时 线为较典型的钟罩形。 最适H pH 图4-6pH对反应速度的影响 ,浓度及缓冲液成分不同而不同 而且常与的等电点不 E6.8 80之间植物及微生物 的敌。 P影响酶促反应速度的原因:(1)环境过酸、过碱会影响酶蛋白构象,使酶本身变 性失活。(2)pH影响酶分子侧链上极性基团的解离,改变它们的带电状态,从而使醇器 性中心的结构发生变化。在最适H时,酶分子上活性中心上的有关基团的解离状态最适 于与底物结合,pH高于或低于最适H时,活性中心上的有关基团的解离状态发生改变 酶和底物的结合力降低,因而酶反应速度降低。(3)H能影响底物分子的解离。可以设 想底物分子上某些基团只有在一定的解离状态下,才适于与酶结合发生反应。若H的改 这些基团的用解离 使 会减慢。 基于上述原 因,pH的 物的 的改变而 提纯 恒定pH值 114
114 向移动。因此,严格地讲,仅仅在酶反应时间已经规定了的情况下,才有最适温度。在 实际应用中,将根据酶促反应作用时间的长短,选定不同的最适温度。如果反应时间比 较短暂,反应温度可选定的略高一些,这样,反应可迅速完成;若反应进行的时间很长, 反应温度就要略低一点,低温下,酶可长时间发挥作用。 五、pH值对酶促反应速度的影响 酶促反应速度与体系的pH值有密切关系。绝大部分酶的活力受其环境的pH影响,在 一定pH下,酶反应具有最大速度,高于或低于此值,反应速度下降,通常将酶表现最大 活力时的pH值称为酶反应的最适pH(optimum pH)(见图4-6)。一般制作V-pH变化曲 线时,采用使酶全部饱和的底物浓度,在此条件下再测定不同pH时的酶促反应速度。曲 线为较典型的钟罩形。 图4-6 pH对反应速度的影响 最适pH有时因底物种类、浓度及缓冲液成分不同而不同。而且常与酶的等电点不一 致,因此,酶的最适pH并不是一个常数,只是在一定条件下才有意义。动物体内的酶, 最适pH大多在6.8~8.0之间;植物及微生物体内的酶,最适pH多在4.5~6.5之间。但也有 例外,如胃蛋白酶为1.9,精氨酸酶(肝脏中)为9.7。 pH影响酶促反应速度的原因:(1)环境过酸、过碱会影响酶蛋白构象,使酶本身变 性失活。(2)pH影响酶分子侧链上极性基团的解离,改变它们的带电状态,从而使酶活 性中心的结构发生变化。在最适pH时,酶分子上活性中心上的有关基团的解离状态最适 于与底物结合,pH高于或低于最适pH时,活性中心上的有关基团的解离状态发生改变, 酶和底物的结合力降低,因而酶反应速度降低。(3)pH能影响底物分子的解离。可以设 想底物分子上某些基团只有在一定的解离状态下,才适于与酶结合发生反应。若pH的改 变影响了这些基团的解离,使之不适于与酶结合,当然反应速度亦会减慢。基于上述原 因,pH的改变,会影响酶与底物的结合,影响中间产物的生成,从而影响酶反应速度。 应该指出,在酶促反应进行的过程中,溶液的pH值会随着反应的进行与体系中成分 的改变而发生变动,因此在酶的提纯或应用中测定酶活力时,必须保持恒定pH值,在实

际操作中多在缓冲液体系中进行。 六、激活剂对酶促反应速度的影响 凡是能提高酶活性的物质,都称激活剂(activator),其中大部分是离子或简单的有 机化合物。激活剂按分子大小可分为三类: (一)无机离子 有阳离子,如K 、Na、Mg2、Zm2、Fe2、Ca2等,其中Mg2是多种激酶及合成 的激活剂 也有阴离 状得的 粉 是韩的 二)中等大 的有机分子 某些还原剂, 如半胱氨酸、还原型谷胱甘肽、抗坏血酸等能激活某些酶,使含巯基 酶中被氧化的二疏键还原成巯基,从而提高酶活性,如木瓜蛋白酶及D-3磷酸甘油醛脱 氢酶。 三)具有蛋白质性质的大分子 这类激活剂专指可对某些无活性的酶原起作用的酶。 激活作用 活性的酶原 有活性的酶 在酶的提取或纯化过程中,酶会因为金属离子激活剂丢失或活性基团巯基被氧化而 活性降低,因此要注意补充金属离子激活剂或加入巯基乙醇等还原剂,使酶恢复活性。 七、抑制剂对酶促反应速度的影响 抑制剂(inhibitor)是指能使酶的必需基团或酶活性部位中的基团的化学性质改变而 降低酶的催化活性,甚至使酶催化活性完全丧失的物质。 抑制剂只能使酶的催化活性降低或丧失,而不引起酶蛋白变性的作用称为抑制作用 。醇蛋白变性而引起酶活力丧失的作用称为变性作用,又称失活作用。所 不的 抑制剂 可逆的 子的活性中心的 比较车的共健拥结用为不制作用 个键相结 不能用 透 恢复酶活性。 常见的不可逆抑制剂有:有机磷化合物,如二异丙基氟磷酸(DIFP)、1605、敌百 虫,它们都能与胰凝乳蛋白酶或乙酰胆碱酯酶活性中心处的丝氨酸残基上的羟基以共价 健牢固结合,因而抑制酶活性。DFP是第二次世界大战中使用过的毒气,它与酶分子的 反应可表示为: 115
115 激活作用 际操作中多在缓冲液体系中进行。 六、激活剂对酶促反应速度的影响 凡是能提高酶活性的物质,都称激活剂(activator),其中大部分是离子或简单的有 机化合物。激活剂按分子大小可分为三类: (一)无机离子 有阳离子,如K +、Na +、Mg 2+、Zn 2+、Fe 2+、Ca 2+等,其中Mg 2+是多种激酶及合成酶 的激活剂。也有阴离子,如经透析获得的唾液淀粉酶活性不高,加入Cl -离子后则活性增 高,故Cl -是唾液淀粉酶的激活剂。而金属离子作为激活剂的作用:一是作为酶的辅因子, 是酶的组成成分,在分离提纯中常被丢失;二是在酶与底物的结合中起桥梁作用。 (二)中等大小的有机分子 某些还原剂,如半胱氨酸、还原型谷胱甘肽、抗坏血酸等能激活某些酶,使含巯基 酶中被氧化的二硫键还原成巯基,从而提高酶活性,如木瓜蛋白酶及D-3-磷酸甘油醛脱 氢酶。 (三)具有蛋白质性质的大分子 这类激活剂专指可对某些无活性的酶原起作用的酶。 活性的酶原 有活性的酶 在酶的提取或纯化过程中,酶会因为金属离子激活剂丢失或活性基团巯基被氧化而 活性降低,因此要注意补充金属离子激活剂或加入巯基乙醇等还原剂,使酶恢复活性。 七、抑制剂对酶促反应速度的影响 抑制剂(inhibitor)是指能使酶的必需基团或酶活性部位中的基团的化学性质改变而 降低酶的催化活性,甚至使酶催化活性完全丧失的物质。 抑制剂只能使酶的催化活性降低或丧失,而不引起酶蛋白变性的作用称为抑制作用 (inhibition)。酶蛋白变性而引起酶活力丧失的作用称为变性作用,又称失活作用。所 以抑制作用与变性作用是不同的。 根据抑制剂与酶的作用方式可将抑制作用分为可逆的与不可逆的两大类。 (一)不可逆的抑制作用 抑制剂与酶的结合是一不可逆反应。抑制剂与酶分子的活性中心的某些必需基团以 比较牢固的共价键相结合,这种结合不能用简单的透析、超滤等物理方法解除抑制剂而 恢复酶活性。这种抑制作用称为不可逆抑制作用(irreversible inhibition)。 常见的不可逆抑制剂有:有机磷化合物,如二异丙基氟磷酸(DIFP)、1605、敌百 虫,它们都能与胰凝乳蛋白酶或乙酰胆碱酯酶活性中心处的丝氨酸残基上的羟基以共价 键牢固结合,因而抑制酶活性。DIFP是第二次世界大战中使用过的毒气,它与酶分子的 反应可表示为: