
3)对于复杂离子,各元素的氧化数之和等于该离子的电荷数。 Fe304 Fe的氧化值为 +8/3 (Fe2O3FeO) 4)若干关键元素原子在化合物中氧化数有定值。 0:-2H20等;-1H202;-0.5K02超氧化钾 :+1一般情况;-1CaH2、NaH 对于新合成、新发现的化合物,当按以上规则确定氧化数发生困难 时,课根据电负性大小予以指定
3) 对于复杂离子, 各元素的氧化数之和等于该离子的电荷数。 Fe3O4 Fe的氧化值为 + 8/3 (Fe2O3·FeO) 4)若干关键元素原子在化合物中氧化数有定值。 O: -2 H2O 等; -1 H2O2 ; -0.5 KO2 超氧化钾 H: +1 一般情况; -1 CaH2 、NaH 对于新合成、新发现的化合物,当按以上规则确定氧化数发生困难 时,课根据电负性大小予以指定
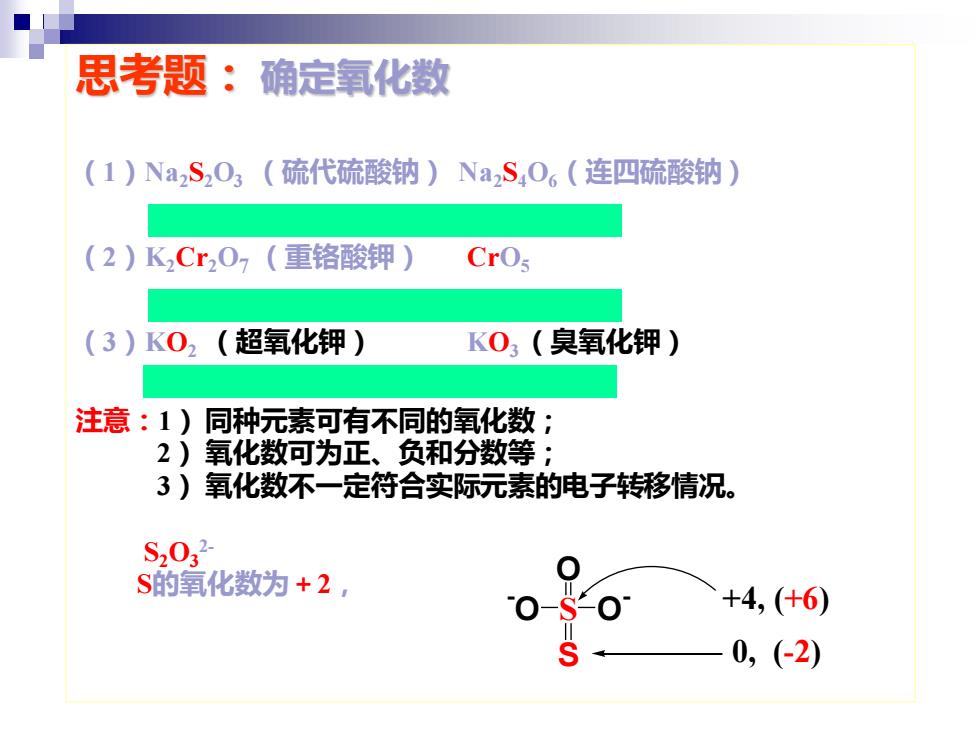
思考题:确定氧化数 (1)Na,S,O3(硫代硫酸钠)NaS,O,(连四硫酸钠) (2)KCr207(重铬酸钾) CrOs (3)K02(超氧化钾) KO3(臭氧化钾) 注意:1)同种元素可有不同的氧化数; 2)氧化数可为正、负和分数等 ; 3)氧化数不一定符合实际元素的电子转移情况。 S2032 S的氧化数为+2, +4,(+6) 0,(-2)
思考题: 确定氧化数 (1)Na2S2O3 (硫代硫酸钠) Na2S4O6(连四硫酸钠) +2 +2.5 (2)K2Cr2O7 (重铬酸钾) CrO5 +6 +10 (3)KO2 (超氧化钾) KO3 (臭氧化钾) -0.5 -1/3 注意:1) 同种元素可有不同的氧化数; 2) 氧化数可为正、负和分数等; 3) 氧化数不一定符合实际元素的电子转移情况。 S2O3 2- S的氧化数为+2, S O - - O O S +4, (+6) 0, (-2)

常用的氧化剂和还原剂举例 常用的氧化剂有活泼的非金属单质(如CL、B2、12、O2),某些氧化物(如MnO2、 PbO2)与过氧化物(如HO2),高价的金属离子(如Fe+、Ce+),含氧酸(HNO、 HzSO,)或高价含氧酸盐(如KMnO4、KClO3、KzCr2O)

表5-1常用氧化剂 氧化剂 还原反应及产物 元素氧化数变化 活泼非金属单质 C(黄绿色气体) Cl+2e一2CI(无色) 0→-1 Br:(红棕色液体) Br+2e一2Br(无色) 0+-1 2(紫色品体) +2e一21(无色) 0+-1 O,(无色气体) O:+2HO+4e一4OH(碱介质) 0+-2 O+4Ht+4e一2H0(酸介质) 0+-2 氧化物 MaOz(黑色固体) M'O+4H++2e一Mm+(浅肉色)+2H0 十4+十2 PbO,(棕色固体) P%'O2+4Ht+2e一PbW+(无色)+2H,O +4→十2 H2O,(无色液体) H:O;+2H++2e-2H2O -1-+-2 高价金属离子 Fe+(黄色) Fe+e一Fe*(浅绿色) +3→+2 Ce+(黄色) Ce++e一Ce+(无色) +4→+3

高价含氧酸或含氧酸盐 KMn(O,(紫色晶体) MO+8H++5e一Mm2++4HO(酸介质) +7→+2 h'Q+2HO+3e一O★(棕黑色)+4OH(中性介质) +7→+4 Mn'O,+2OH+e一MnO+H2O(碱介质) +7→+6 KCO(白色固体) CIO+2H++2e一C+HO(酸介质) +1+-1 C1'0+H0+2e一C+2OH(碱介质) +1+-1 KCIO,(白色固体) CIO十6H++6e一C+3HO(酸介质) +5-+-1 C'O5+3H2O+6e一C+6OH(碱介质) +5-◆-1 K,CrO方(橙色晶体) CriO月+14H++6e一2C2+(绿色)+7H20 +6→+3 HNO方(无色液体) N·O方+2H++e一NO2↑(棕红)+HO(浓酸) +5+十4 N"O方+4H++3e一NO忄(无色)+2HO(稀酸) +5++2 N"O方+10H++8c一NH时(无色)+3HO(极稀酸) +5→-3 2N“O+10H+8e一WO4(无色)+5HOX极稀酸) +5++1 浓HSO,(无色液体) 2S0+8H*+4e=2S02↑+4HO +6-+4 K,SOa(白色固体) Sx0g+2e一2S0 +7→+6