
第2章化学反应速率与化学平衡 学习要求 1.掌握浓度、温度、催化剂等因素对化学反应速率的影响, 并能运用活化能和碰撞理论加以解释。 2.熟悉化学平衡的概念,理解平衡常数的意义,掌握有关化 学平衡的计算。 3.了解影响化学平衡移动的因素
第2章 化学反应速率与化学平衡 学习要求 1.掌握浓度、温度、催化剂等因素对化学反应速率的影响, 并能运用活化能和碰撞理论加以解释。 2.熟悉化学平衡的概念,理解平衡常数的意义,掌握有关化 学平衡的计算。 3.了解影响化学平衡移动的因素

第二章化学反应速度与化学平衡 一、化学反应速率 1、化学反应速率
第二章 化学反应速度与化学平衡 一、化学反应速率 1、化学反应速率

CB A→B 反应物 产物 CB(1) B=CB2)-Ca0-△cE t/s t2-t1 △t 12 产物浓度随时间的变化曲线 CB:产物的浓度,单位为molL1 t:反应时间,单位为:s、min、hr等。 v:反应速率,单位为:mol.L-1.sl VB:平均反应速率,单位为:molL1.sl
CB t t / s 1 t2 CB(1) CB(2) 产物浓度随时间的变化曲线 t c t t c c v B B B B = − − = 2 1 (2) (1) A B 反应物 产物 CB : 产物的浓度,单位为 mol.L-1 t : 反应时间,单位为 : s 、min、hr 等。 v : 反应速率,单位为: mol.L-1 .s-1 : 平均反应速率,单位为: mol.L-1 .s-1 vB
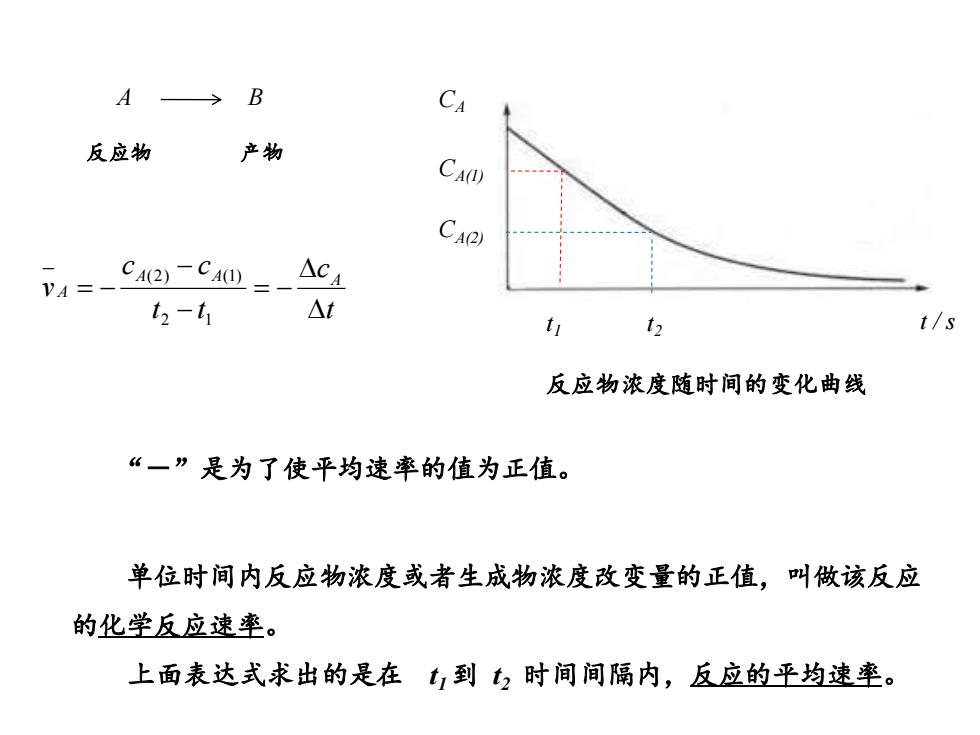
A> B 反应物 产物 CA(1) CA) 4=-CA2-C40=-△c4 12-t △t 12 t/s 反应物浓度随时间的变化曲线 “一”是为了使平均速率的值为正值。 单位时间内反应物浓度或者生成物浓度改变量的正值,叫做该反应 的化学反应速率。 上面表达式求出的是在t,到?时间间隔内,反应的平均速率
CA t t / s 1 t2 CA(1) CA(2) 反应物浓度随时间的变化曲线 t c t t c c v A A A A = − − − = − 2 1 (2) (1) A B 反应物 产物 “-”是为了使平均速率的值为正值。 单位时间内反应物浓度或者生成物浓度改变量的正值,叫做该反应 的化学反应速率。 上面表达式求出的是在 t1到 t2 时间间隔内,反应的平均速率

例 在400℃下,把0.1molC0和0.1 mol NO2引人体积为1L的容器中,每隔10s 抽样,快速冷却,终止反应,分析CO的浓度结果如下。 CO+NO2→CO2+NO C0浓度/(molL-1) 0.100 0.067 0.050 0.040 0.033 反应时间t/s 0 10 20 30 40 解 0~10秒(s)的时间间隔内,用C0表示的平均反应速率为 o=-Ae=-0.067-0.100m01L=0.033 molLs △t (10-0)s
1 1 1 0.0033 . . (10 0) (0.067 0.100) . − − − − = − − = − = − mol L s s mol L t c v CO CO 解 0 ~ 10秒(s)的时间间隔内,用 CO 表示的平均反应速率为