
1一21快反应) 2I+H2→2H(慢反应) 后一基元反应是一个三分子反应。 ④非基元反应不能谈反应分子数,不能认为反应方程式中反应物的计量数 之和就是反应的分子数。 连率方程式 反应级数 k的量纲 o=k 零级反应 浓度·时间1 v=kc(A) 一级反应 时间1 级反应 浓度1.时间1 三级反应 浓度2.时间1 零级反应(zero order reaction):反应速率与反应物浓度的零次方成正比,也就 是说,速率是一个常数许多发生在固体表面的反应是零级的,如氧化亚氮在细颗 粒金表面的热分解就是一实例: N,0g)uN,g)+20,e v=k(CO)°=k §3-2温度对反应速率的影响 反应温度升高不仅可以使反应物分子的运动速率增大,从而使单位时间内反 应物分子间的碰撞次数增加,更重要的是,温度升高,使较多的具有平均能量的 普通分子获得能量而变成活化分子,从而使单位体积内活化分子的百分数增大, 结果使单位时间有效碰撞次数增大,反应速率也就相应地增大。下面介绍反应速 率常数与温度之间的定量关系。 一、an't Hoff规则: 根据大量实验结果可以归纳一条经验规律:一般的化学反应,如果反应物的 24 浓度或分压恒定,反应温度每升高10水,其反应速率增加2一4倍。 6

二、何仑尼乌斯(S.Arrhenius)公式: 1899年,阿仑尼乌斯(S.Arrhenius)根据实验结果,提出在给定的温度变化 范围内反应速率常数K与温度T之间的关系为 k=A·e粉 其中A为一常数,称为“指前因子”或“频率因子”,E为反应的活化能, R为气体常数。 取对数得 b=爱h4 或 (D以g太(或血)对1T作图得 4率二名03呢 直线。由直线的斜率ˉ2303(或ˉ应) 可求出Ea:由直线的截距lgA(或lnA)可求 出A。 依国3孩国软用4文了 1 aP色36s棉8a (2)若反应在温度TK时速率常数为K1,在温度TK时速率常数为K2, 则由阿仑尼乌斯公式的对数式知 K2最方A B。 网代成利“会高宁京,用比成送打有关 例:反应2NO2(g)2NO(g)+02(g) Ea=1.14×103Jmo1,600K时速度常数k1=0.75mo1s1,求700K时 速度常数k2. 解: 7
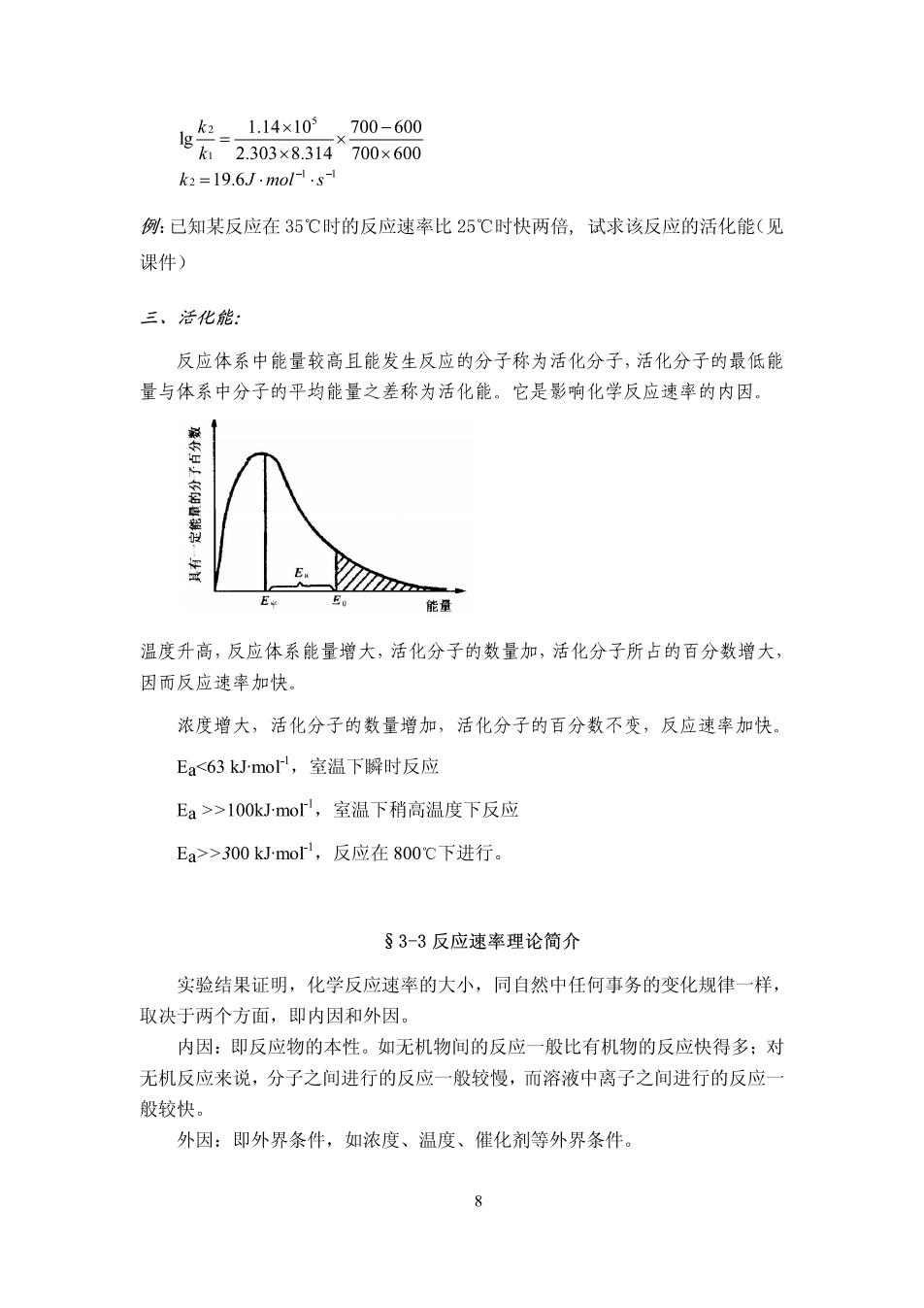
尝n k2=19.6J.mol-.s- 例:已知某反应在35℃时的反应速率比25℃时快两倍,试求该反应的活化能(见 课件) 三、活化能 反应体系中能量较高且能发生反应的分子称为活化分子,活化分子的最低能 量与体系中分子的平均能量之差称为活化能。它是影响化学反应速率的内因 E 能量 温度升高,反应体系能量增大,活化分子的数量加,活化分子所占的百分数增大, 因而反应速率加快 浓度增大,活化分子的数量增加,活化分子的百分数不变,反应速率加快 Ea<63kJmo,室温下瞬时反应 Ea>>100 kJ-mol,室温下稍高温度下反应 Ea>>300 kJ-mol,反应在800℃下进行。 §3-3反应速率理论简介 实验结果证明,化学反应速率的大小,同自然中任何事务的变化规律一样, 取决于两个方面,即内因和外因。 内因:即反应物的本性。如无机物间的反应一般比有机物的反应快得多:对 无机反应来说,分子之间进行的反应一般较慢,而溶液中离子之间进行的反应 般较快。 外因:即外界条件,如浓度、温度、催化剂等外界条件。 8