
第九章氧化还原反应与氧化还原滴定法 目的要求: 1.掌握氧化数的概念及氧化数规则 2.掌握原电池的组成,电极反应,电池符号:掌握电极电势 的概念及影响因素,掌握标准电极电势的概念 3.熟练掌握Nernst方程,掌握浓度、压力、酸度、沉淀反应、 配位反应对电极电势的影响,并能熟练的运用Nernst方程式进行 计算 4.掌握原电池电动势E与电池反应△rGm的关系,掌握 标准电动势与氧化还原反应标准平衡常数K的关系 5.掌握电极电势的应用:①表示水溶液中物质氧化、还原有 力的强弱:②判断氧化还原反应的方向:③判断氧化还原反应进 行的程度:④测定水溶液中离子的浓度(活度) 6.掌握元素电势图及其应用 7.了解氧化还原滴定法的基本特点,了解条件电极电势的概 念,了解条件平衡常数的概念,掌握氧化还原滴定对条件电极电 势差值的要求 8.了解氧化还原滴定曲线的计算方法,了解氧化还原滴定法 所用的指示剂 9.掌握高锰酸钾溶液的配制与标定,了解高锰酸钾法、碘量 法和重铬酸钾法的应用 10.掌握氧化还原平衡和氧化还原滴定法的计算 重点: 氧化数的概念和原电池:Nernst方程的应用:电极电势及其应用: 高锰酸钾法、碘量法和重铬酸钾法 1

难点: Nernst方程的应用:电势图及其应用:氧化还原滴定曲线:碘量 法。 课堂组织: 大多数的酸碱反应,沉淀反应,配位反应等,因为没有发生元 素氧化数的变化,统称为非氧化还原反应,与之对应的另一类涉 及氧化数变化的反应,则称为氧化还原反应。氧化还原反应是一 类重要的化学反应,应用广泛,是化学热能和电源的来源之一。 §9.1氧化还原反应 一、氧化与还原概念的演变 起先:与氧结合的过程叫氧化: 2Mg(sHOz(g)=2MgO(s)覆盖范围比较小 后来:失电子的过程叫氧化Mg一Mg2+2e揭露实质,扩大覆盖范 现在:对2P(s)+3C(g)=2PCl(①)显然“失电子”不明显 二、氧化数Oxidation number:: 1.定义:假设在形成化学键时成键电子转移给电负性较大的原子 时,所求得的原子所带的电荷数。是元素的一种表观电荷数。 2.取值:零、正负整数、分数 3.确定:规则同于化合价 ★在单质中,元素的氧化值为零。 ★在单原子离子中,元素的氧化值等于离子所带的电荷数 ★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化 物(如NaH,CaH2)中,氢的氧化值为-l ★通常,在化合物中氧的氧化值为-2;但在过氧化物(如 Hz02,N202,Ba02)中氧的氧化值为-1;而在0F2和02F2中,氧

的氧化值分别为+2和+1。 ★在所有氟化物中,氟的氧化值为-1。 ★碱金属和碱土金属在化合物中的氧化值分别为+1和+2。 ★在中性分子中,各元素氧化值的代数和为零。在多原子原子离 子中各元素氧化值的代数和等于离子所带的电荷数。 例:S202(连二亚硫酸根)中硫的氧化数 00 2x+4X(-2)=-2 X=3 0-S-S0 氧化值的概念也有不足之处,不是十分严格,如CH4,CH4,CHCl, CH2CL,CHC13和CC14中C的原子价为+4,氧化数却不同,依次 为-4,-2,0,+2和+4。还有一些例子,尽管如此,用氧化值讨论 仍很方便。 三、氧化还原反应: 1.氧化(oxidation)和还原(reduction):Cl2+2Ki=2KC1+I2 在氧化和还原反应中,元素氧化数升高的过程称为氧化。在氧化 和还原反应中,元素氧化数降低的过程称为还原。 1)氧化剂(oxidant):得电子的物质,氧化数降低。 还原剂(reductant):失电子的物质,氧化数升高。 2)氧化反应(oxidation reaction):失电子的过程 还原反应(reduction reaction):得电子的过程 3)氧化性:得电子的能力 还原性:失电子的能力 2.氧化还原半反应和氧化还原电对 一个氧化还原反应可分写成表示氧化、还原过程的两个半反 应,更明确氧化剂、还原剂在反应中的变化。 例:Cl2+2KI=2KC+2 Cl2发生还原反应:Cl2+2e=2CIr 12发生氧化反应:21-2e=2 氧化还原半反应式中,同一元素的两个不同氧化值的物种组 成了电对,其中氧化数较高的物质称为氧化型物质,氧化数较低 的物质称为还原型。 3

同一元素的氧化型和还原型构成的共轭体系称为氧化还原电对 (redox couple)。用“氧化型/还原型"表示。 例:Cl2/C,l21I 氧化还原反应是由两个电对构成的反应系统。可以表示为: 还原型(1)+氧化型〔2】二氧化型(1)+还原型〔2) ,氧化还原电对的书写形式与反应式有关。 半反应 电对 MnO4-+8H++5e=Mn2++4H2O MnO4-/Mn2+ MnO4-+2H20+3e=MnO2+40H- MnO4-/Mn20 ,在氧化还原电对中,氧化型的氧化能力越强,则其共轭还原型的 还原能力越弱:反之,还原型的还原能力越强,则其共轭氧化型 的氧化能力越弱。氧化还原反应是两个氧化还原电对共同作用的 结果,反应一般按照较强的氧化剂和较强的还原剂相互作用的方 向进行。 §9.2氧化还原反应方程式的配平(自学) 一、氧化数法: 氧化数法配平基本原则是:反应中氧化剂元素氧化数降低值 等于还原剂元素氧化数增加值,或得失电子的总数相等。 例: 4
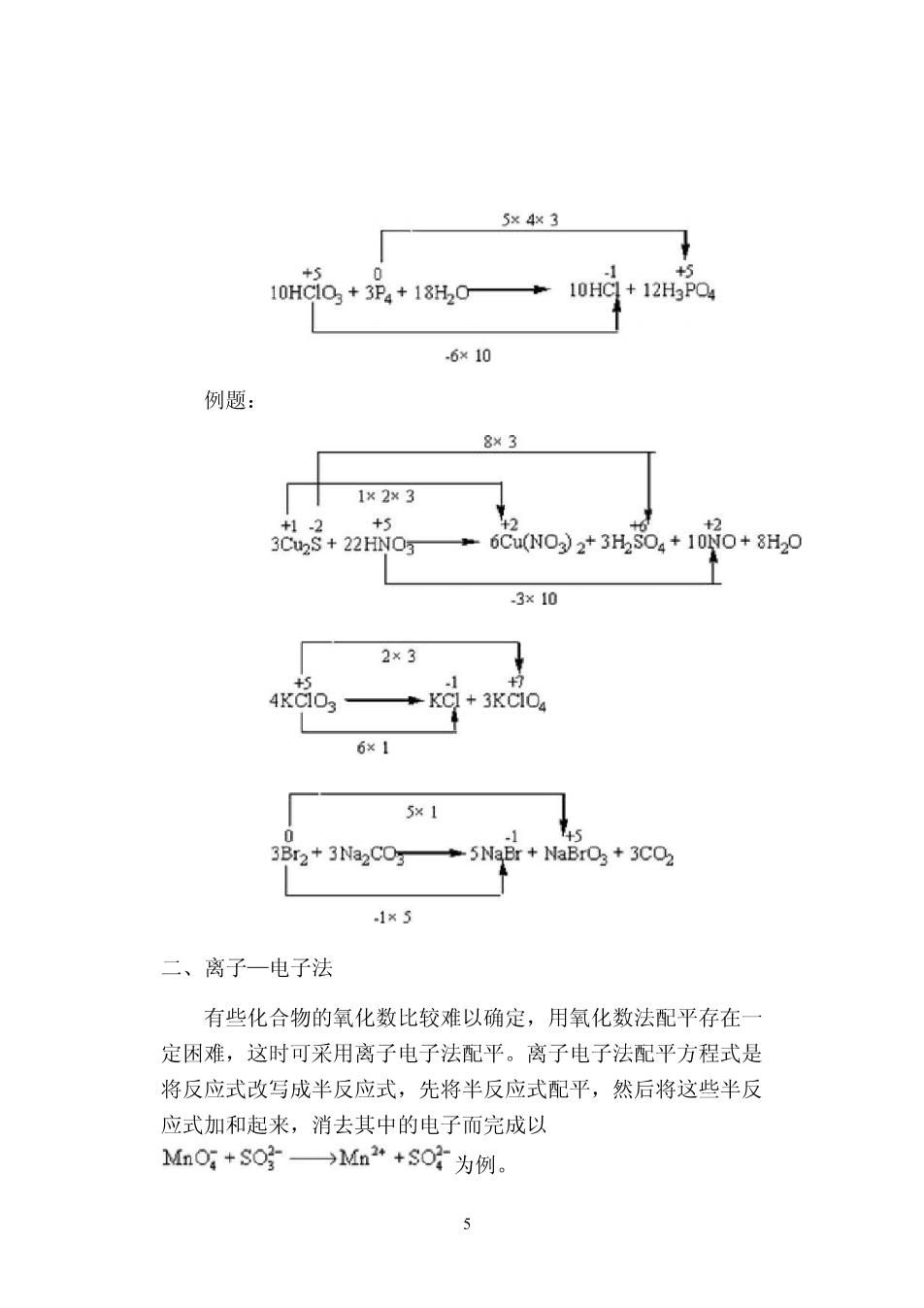
5×43 10HG0,+3,+18,0 +10HC+12H3PQ4 -6×10 例题: 8×3 1×2×3 +6Cu(NO)2+3H2S04+10N0+8H20 3x10 2×3 4KC03 ◆KC+3KCOa 6×1 5x1 3Br2+3Na2CO3 ◆5NaBr+NaBrO3+3C02 1×5 二、离子一电子法 有些化合物的氧化数比较难以确定,用氧化数法配平存在 定困难,这时可采用离子电子法配平。离子电子法配平方程式是 将反应式改写成半反应式,先将半反应式配平,然后将这些半反 应式加和起来,消去其中的电子而完成以 Mn0+S0g→Mn2“+S0为例。 5