
§6-5稳态近似与平衡态近似 是处理复杂反应动力学方程最常用的方法 可使很难求解的问题简化为一般的代数问题 ①稳态近似: B为活泼的中间产物 dCB=kCa-k,Cp dt 若2≥>k1B中间产物的浓度很小
1 §6-5 稳态近似与平衡态近似 是处理复杂反应动力学方程最常用的方法 可使很难求解的问题简化为一般的代数问题 ① 稳态近似: B 为活泼的中间产物 A B B k C k C dt dC = 1 − 2 若 k2 >> k1 B 中间产物的浓度很小

≈0 B的生成速率等于消耗速率 dt dCa=kC4-k,CB≈0 dt 这就是中间物B稳态近似 Ca= k2 中间物B: 游离原子,自由基, 活泼中间 物分子等 可以利用此稳态近似处理复杂反应
2 0 dt dCB 这就是中间物 B 稳态近似 B 的生成速率等于消耗速率 = 1 A − 2 B 0 B k C k C dt dC B CA k k C 2 1 = 中间物 B:游离原子,自由基,活泼中间 物分子等 可以利用此稳态近似处理复杂反应

稳态近似:当反应过了诱导期后,一切活 泼的反应中间物的浓度视为不随t改变 未达诱导期无效,如爆炸反应 反应中有多种中间物,则有多个这样的代数和 解出中间物浓度,以简化复杂反应动力学 例:H2+2→2HⅢ (1) 21 (2) 2I+H2 2HI 工为中间物 (3)2I ,12 dCL-kCn-k.CiCu-k;Cj=0 dt 3
3 未达诱导期无效,如爆炸反应 反应中有多种中间物,则有多个这样的代数和 解出中间物浓度,以简化复杂反应动力学 例:H2 + I2 → 2HI (1)I2 → 2I (2)2I + H2 → 2HI (3)2I → I2 k1 k2 k3 I 为中间物 稳态近似:当反应过了诱导期后,一切活 泼的反应中间物的浓度视为不随 t 改变 0 2 3 2 1 2 2 2 = I − I H − I = I k C k C C k C dt dC
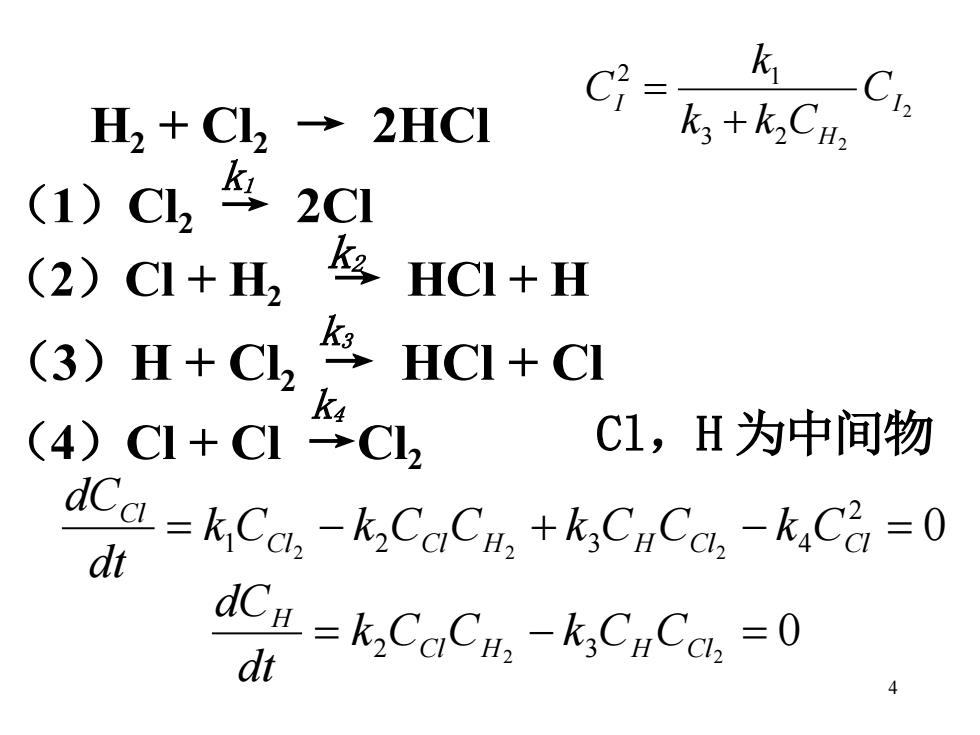
C2= k一C1, H2 +Cl2 2HCI ka+k2CHa (1)C2 2C1 (2)( CI+H2 HCI+H (3)H+C2 k9, HCI+CI k4 (4)C1+C 1→C2 C1,H为中间物 dCa-kCo.-k.CuCu.+kCyCo.-k.Ci-0 dt dCn-kCoCn-k:CnCcl=0 dt
4 2 3 2 2 2 1 I H I C k k C k C + = H2 + Cl2 → 2HCl (1)Cl2 → 2Cl (2)Cl + H2 → HCl + H (3)H + Cl2 → HCl + Cl (4)Cl + Cl →Cl2 k1 k2 k3 k4 Cl,H 为中间物0 2 = 1 Cl2 − 2 Cl H2 + 3 H Cl2 − 4 Cl = Cl k C k C C k C C k C dt dC 0 2 2 3 2 = Cl H − H Cl = H k C C k C C dt dC

平衡态近似: A空n0 k1很大时,且k2最小 2这步反应很慢,称控制步骤 用该步骤的反应速率代替整个反应的速率 其它反应相对较快,都已近似处在平衡态 这就是平衡态 5
5 ② 平衡态近似: k-1很大时,且 k2最小 k2这步反应很慢,称控制步骤 用该步骤的反应速率代替整个反应的速率 其它反应相对较快,都已近似处在平衡态 ——这就是平衡态