
COO C00 Coo- HN-C-H C-H HNCH CH 0 00c C00 H OH 0P0 Y酸基谷氢酸 羟随氨酸 磷酸丝氨酸 CH,-NH-CH:-COOH H2N-CH2-CH-CH2-CH2-CH-COOH OH NHz N甲基甘氨酸(肉氨酸 5羟赖氨酸 CH:-NH-CH:-CH2-CH2-CH2-CH-COOH 6-N-甲基赖氨酸 四、非蛋白质氨基酸 除了参与蛋白质组成的20种氨基酸和少数稀有氨基酸外,还在各种组织和细胞中发 现很多其它氨基酸,它们不存在于蛋白质中,而是以游离或结合状态存在于生物体内, 所以称为非蛋白质氨基酸。这些氨基酸大多数是蛋白质中存在的L型氨基酸的衍生 物,如鸟氨酸(ornithine)、瓜氨酸(citrulline)、高丝氨酸(homeserine)、高半胱氨酸等 但也有一些是B、Y-或6氨基酸,如B丙氨酸、 Y氨基丁酸。这些氨基酸虽然不参与 蛋白质组成,但在生物体中往往具有 定的生理功能,如鸟氨酸和瓜氨酸是合成精氨 的前体,B丙氨酸是维生素泛酸的组成成分,Y-氨基丁酸是神经传导的化学物质。植物 中含有很多非蛋白质氨基酸,其中有些具有特殊的生物功能,但大多数非蛋白质氨基酸 的功能还不清楚。 另外,有些非蛋白质氨基酸呈D-构型,如人牙齿蛋白中含有D-精氨酸。D-氨基酸的 存在也与某些蛋白质的功能密切相关。一些非蛋白质氨基酸的分子结构如下: 16
16 四、非蛋白质氨基酸 除了参与蛋白质组成的 20 种氨基酸和少数稀有氨基酸外,还在各种组织和细胞中发 现很多其它氨基酸,它们不存在于蛋白质中,而是以游离或结合状态存在于生物体内, 所以称为非蛋白质氨基酸。这些氨基酸大多数是蛋白质中存在的 L-型α-氨基酸的衍生 物,如鸟氨酸(ornithine)、瓜氨酸(citrulline)、高丝氨酸(homeserine)、高半胱氨酸等, 但也有一些是β-、γ-或δ-氨基酸,如β-丙氨酸、γ-氨基丁酸。这些氨基酸虽然不参与 蛋白质组成,但在生物体中往往具有一定的生理功能,如鸟氨酸和瓜氨酸是合成精氨酸 的前体,β-丙氨酸是维生素泛酸的组成成分,γ-氨基丁酸是神经传导的化学物质。植物 中含有很多非蛋白质氨基酸,其中有些具有特殊的生物功能,但大多数非蛋白质氨基酸 的功能还不清楚。 另外,有些非蛋白质氨基酸呈 D-构型,如人牙齿蛋白中含有 D-精氨酸。D-氨基酸的 存在也与某些蛋白质的功能密切相关。一些非蛋白质氨基酸的分子结构如下:

HNCH CH,CH,CHCOOH H.NCH CH,CH,COOH H.NCONHCH,CH CH-CHCOOH NH 7氨基丁酸 L瓜氨酸 H.NCH.CH.COOH HO,S-CH:-CHz -NH: CH:-CH:-CH-COOH CH:-CH-CH-COOH SH 牛酸 高半院氨酸 五、氨基酸的性质 氨基酸的性质是由它的结构决定的,不同氨基酸之间的差异只是在侧链上,因此氨 基酸具有许多 共同 。个别药 基酸由于其侧链的特殊结构还有许多特殊的性质。 (一)氨基酸的酸碱性质和等电 根据Bronsted-Lowry的酸碱学说,酸是质子的供体,碱是质子的受体,氨基酸分子 中既含有氨基,又含有羧基,在水溶液中它既可以释放质子作为酸,又可以接受质子作 为碱,所以氨基酸是两性电解质(ampholyte)。实验证明氨基酸在水溶液中或固体状态时 是以两性离子( ar ion)形式存在的 所谓两性离 是指在 氨基酸分 上带有 等量的正负两种电荷,由于正负电荷相互中和而呈电中性,这种形式又称兼性离子 (zwitterions)或偶极离子。 COOH H-C-COO R R 中性分子形式 两性离子形式 因为氨基酸是两性电解质,所以它在溶液中的带电状况随溶液的H变化而变化,即 氨基酸上的氨基和羧基的解离取决于溶液的H。例如甘氨酸,它完全质子化时可以看作 是一个二元弱酸,其解离情况如下: 17
17 五、氨基酸的性质 氨基酸的性质是由它的结构决定的,不同氨基酸之间的差异只是在侧链上,因此氨 基酸具有许多共同的性质。个别氨基酸由于其侧链的特殊结构还有许多特殊的性质。 (一)氨基酸的酸碱性质和等电点 根据 Bronsted-Lowry 的酸碱学说,酸是质子的供体,碱是质子的受体,氨基酸分子 中既含有氨基,又含有羧基,在水溶液中它既可以释放质子作为酸,又可以接受质子作 为碱,所以氨基酸是两性电解质(ampholyte)。实验证明氨基酸在水溶液中或固体状态时 是以两性离子(dipolar ion)形式存在的。所谓两性离子是指在同一个氨基酸分子上带有 等量的正负两种电荷,由于正负电荷相互中和而呈电中性,这种形式又称兼性离子 (zwitterions)或偶极离子。 因为氨基酸是两性电解质,所以它在溶液中的带电状况随溶液的 pH 变化而变化,即 氨基酸上的氨基和羧基的解离取决于溶液的 pH。例如甘氨酸,它完全质子化时可以看作 是一个二元弱酸,其解离情况如下:

H ·HNec0OH·HN-C CO0 H.N-c Co0 H H (1) 2 (3) 在一定的pH条件下,氨基酸分子中所带的正电荷和负电荷数相同,即净电荷为零 此时溶液的pH称为 基酸 等电点( o,)用符号pl表示也就是说 溶液中的氨基酸绝大多数以两性离子形式存在,净电荷为零,在电场中既不向正极移动, 也不向负极移动。由于静电作用,在等电点时,氨基酸的溶解度最小。 各种氨基酸的结构不同,在给定pH条件下不同氨基酸的解离情况不同,即带电状况 不同。各种氨基酸都有其特定的等电点,即在一特定pH条件下以两性离子形式存在,净 电荷为零,在电场中不移动。当 溶液的 小于某氨基酸的等电点时,该氨基酸带正电荷 在电场中向负极移动。 当溶液的pH大于等电点时,该氨基酸带负电荷,在电场中向正极 移动。而在同一H条件下,各种不同氨基酸的带电状况不同,所以可根据这一性质,通 过电泳法或离子交换法将氨基酸进行分离制备。氨基酸的羧基、氨基以及侧链上的可解 离基团都有一个特定的pK值(即解离常数的负对数)。pK的编号通常是从酸性最强的基 团的解离开始,分别用 表示。由于各种氨基酸分子上所含氨基、羧基等 基团的数目不同以及各 使每种氨基酸都有各 特定的等 点,碱 性氨基酸的等电点较高,如Ag为10.76,而酸性氨基酸的等电点相当低,如G山为3.22 氨基酸的等电点可由实验测定,也可根据氨基酸分子中所带的可解离基团的pK值来 计算,如根据甘氨酸的解离方程,可推导出计算等电点的公式。当甘氨酸在酸性溶液中, 它是以带净的正电荷的形式存在的, 可以看价 弱酸 具有两个可解离的上 即COOH和-NH,上的H。根据上述甘氨酸的解离方程可得到: K,=HIGly"] [Gly]=]Gly*] [Gly*] K-']Gly] [Gly]-Gly'IK Gly H K、K,为解离常数,当达到等电点时, [Gly]=[Gly 即: [H*][Gly*][Gly*]K2 则KK= K H 18
18 在一定的 pH 条件下,氨基酸分子中所带的正电荷和负电荷数相同,即净电荷为零, 此时溶液的 pH 称为该氨基酸的等电点(isoelectric point),用符号 pI 表示。也就是说, 溶液中的氨基酸绝大多数以两性离子形式存在,净电荷为零,在电场中既不向正极移动, 也不向负极移动。由于静电作用,在等电点时,氨基酸的溶解度最小。 各种氨基酸的结构不同,在给定 pH 条件下不同氨基酸的解离情况不同,即带电状况 不同。各种氨基酸都有其特定的等电点,即在一特定 pH 条件下以两性离子形式存在,净 电荷为零,在电场中不移动。当溶液的 pH 小于某氨基酸的等电点时,该氨基酸带正电荷, 在电场中向负极移动。当溶液的 pH 大于等电点时,该氨基酸带负电荷,在电场中向正极 移动。而在同一 pH 条件下,各种不同氨基酸的带电状况不同,所以可根据这一性质,通 过电泳法或离子交换法将氨基酸进行分离制备。氨基酸的羧基、氨基以及侧链上的可解 离基团都有一个特定的 pK 值(即解离常数的负对数)。pK 的编号通常是从酸性最强的基 团的解离开始,分别用 pK1、pK2、 表示。由于各种氨基酸分子上所含氨基、羧基等 基团的数目不同以及各种基团的 pK 值的不同,使每种氨基酸都有各自特定的等电点,碱 性氨基酸的等电点较高,如 Arg 为 10.76,而酸性氨基酸的等电点相当低,如 Glu 为 3.22。 氨基酸的等电点可由实验测定,也可根据氨基酸分子中所带的可解离基团的 pK 值来 计算,如根据甘氨酸的解离方程,可推导出计算等电点的公式。当甘氨酸在酸性溶液中, 它是以带净的正电荷的形式存在的,可以看作是一个二元弱酸,具有两个可解离的 H +, 即 COOH 和-NH3 +上的 H +。根据上述甘氨酸的解离方程可得到: [Gly ] [H ][Gly ] K1 + + ± = K1 [H ][Gly ] [Gly ] + ± + = [Gly ] [H ][Gly ] K2 ± + - = [H ] [Gly ]K [Gly ] 2 + ± - = K1、K2 为解离常数,当达到等电点时, [Gly + ]=[Gly ] 即: K1 [H ][Gly ] + ± = [H ] [Gly ]K2 + ± 则 K1K2=[H + ] 2

方程两边取负对数:-1gH了=-1gK一1gK 则 2pH=pK+pK2 由此可推导出等电点计算公式:pH=pl=pK+PpK, 2 从上述结论可知,等电溶液的H与离子浓度无关,其值决定于两性离子两侧的可解 离基团的pK值 通过测定氨基酸的滴定曲线可以求得氨基酸的各个解离基团的p水值。图21为甘氨 酸的滴定曲线。甘氨酸有两个可解离基团,a-COOH和aNH店,它们的pK值分别是 2.34和9.60。当进行甘氨酸滴定时,以外加的碱量为横坐标,以p值为纵坐标可得S 形曲线。从曲线可知,在pH2.34处有一转折,这时相当于50%的羧基解离,释放出的 被Or中和,溶液中[HNCH,COO=HNCH,CO0],此时pH=pK,(a-COOH) 当继续加入碱,在pH9.6处又有一转折,此时相当于有50%的-NH;作为质子供体而解 离,释放出的H被OH中和,溶液中HNCH,COO]=H,NCH,COO],此时的pH=pK, (-NH;)。pK值就是指某种解离基团有一半解离时的pH值,pK值的大小可以表示解离 基团酸性的强弱,pK值小则酸性强。在滴定曲线中间pH=5.97处有一转折点,此时甘 氨酸分子上的净电荷为零,绝大多数的甘氨酸分子以两性离子形式存在,此时的pH就是 甘氨酸的等电点。一氨基一羧基氨基酸的等电点都可以根据公式p=DK十PK求 得,所以甘氨酸的等电点为:p1=234+960=5.97. 2 19
19 方程两边取负对数: -lg[H + ] 2=-lgK1-lgK2 则 2pH=pK1+pK2 由此可推导出等电点计算公式: 2 (pK pK ) pH pI 1 + 2 = = 从上述结论可知,等电溶液的 pH 与离子浓度无关,其值决定于两性离子两侧的可解 离基团的 pK 值。 通过测定氨基酸的滴定曲线可以求得氨基酸的各个解离基团的 pK 值。图 2-1 为甘氨 酸的滴定曲线。甘氨酸有两个可解离基团,α-COOH 和α-NH + 3 ,它们的 pK 值分别是 2.34 和 9.60。当进行甘氨酸滴定时,以外加的碱量为横坐标,以 pH 值为纵坐标可得 S 形曲线。从曲线可知,在 pH 2.34 处有一转折,这时相当于 50%的羧基解离,释放出的 H + 被 OH -中和,溶液中[H + 3 NCH2COOH] = [H + 3 NCH2COO - ],此时 pH=pK1(α-COOH)。 当继续加入碱,在 pH 9.6 处又有一转折,此时相当于有 50%的-NH + 3 作为质子供体而解 离,释放出的 H +被 OH -中和,溶液中[H + 3 NCH2COO - ] = [H2NCH2COO - ],此时的 pH=pK2 (-NH + 3 )。pK 值就是指某种解离基团有一半解离时的 pH 值,pK 值的大小可以表示解离 基团酸性的强弱,pK 值小则酸性强。在滴定曲线中间 pH=5.97 处有一转折点,此时甘 氨酸分子上的净电荷为零,绝大多数的甘氨酸分子以两性离子形式存在,此时的 pH 就是 甘氨酸的等电点。一氨基一羧基氨基酸的等电点都可以根据公式 2 (pK pK ) pI 1 + 2 = 求 得,所以甘氨酸的等电点为: 5.97 2 2.34 9.60 pI = + =
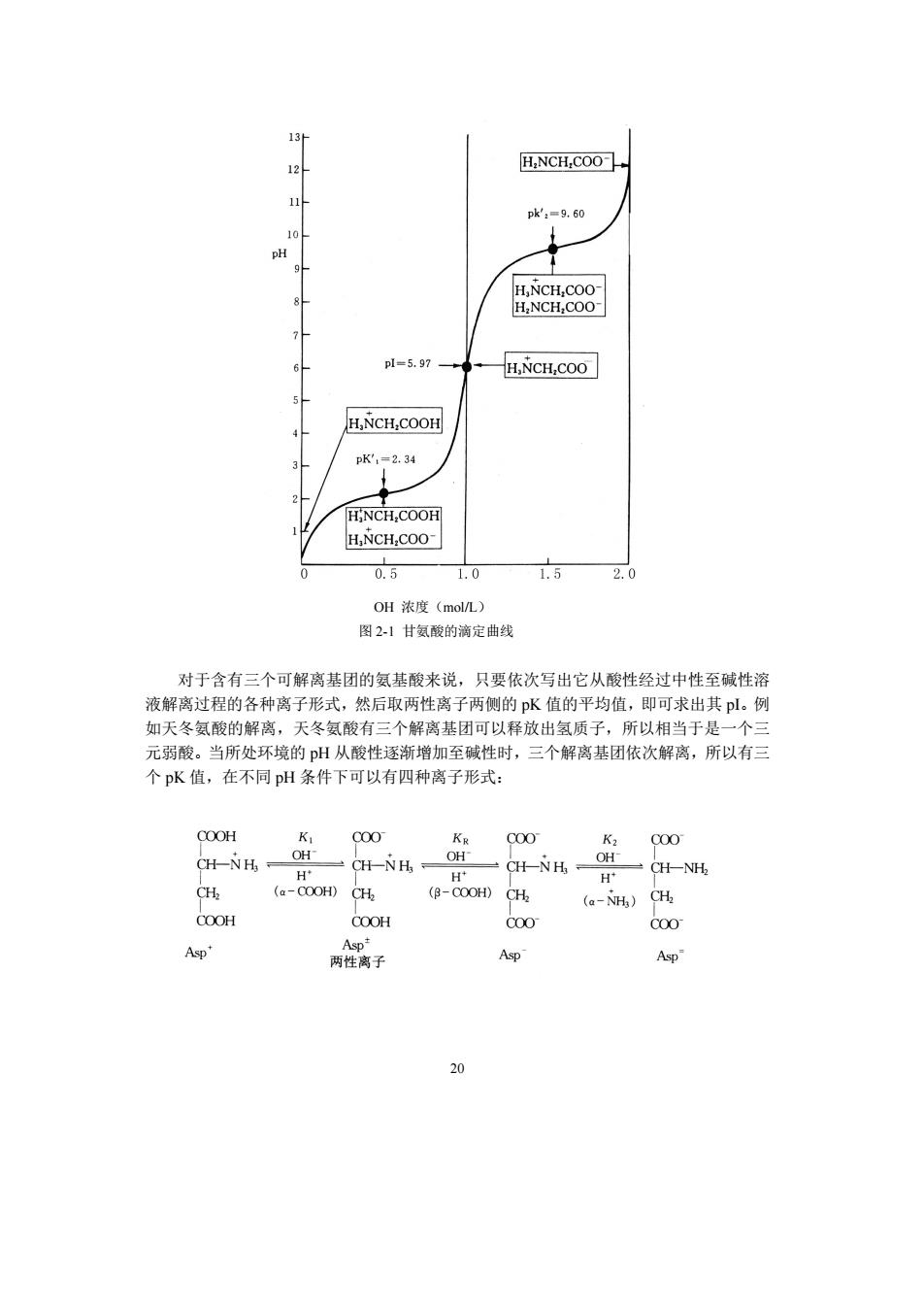
H,NCH,COO- 1 pk:=9.60 pl=5.97 -H.NCH,COO H.NCH.COOH 4 3 k',-2.34 2- H.NCH.COOH H.NCH.COO- 0.5 1.0 1.5 OH浓度(molL) 图2】甘氨酸的滴定曲线 对于含有三个可解离基闭的氨基酸来说。只要依次写出它从酸性经过中性至碱性溶 液解离过程的各种离子形式,然后取两性离了两侧的p水值的平均值,即可求出其p,例 如天冬氨酸的解离,天冬氨酸有三个解离基团可以释放出氢质子,所以相当于是 元弱酸。当所处环境的H从酸性逐渐增加至碱性时,三个解离基团依次解离,所以有三 个pK值,在不同pH条件下可以有四种离子形式: COOH 000 CH-NH= CH (a-C0OH)CH (R-COOH C H CH-NH (a-H CH COOH COOH C00 C00 Asp' 两性 Asp Asp 20
20 OH 浓度(mol/L) 图 2-1 甘氨酸的滴定曲线 对于含有三个可解离基团的氨基酸来说,只要依次写出它从酸性经过中性至碱性溶 液解离过程的各种离子形式,然后取两性离子两侧的 pK 值的平均值,即可求出其 pI。例 如天冬氨酸的解离,天冬氨酸有三个解离基团可以释放出氢质子,所以相当于是一个三 元弱酸。当所处环境的 pH 从酸性逐渐增加至碱性时,三个解离基团依次解离,所以有三 个 pK 值,在不同 pH 条件下可以有四种离子形式: