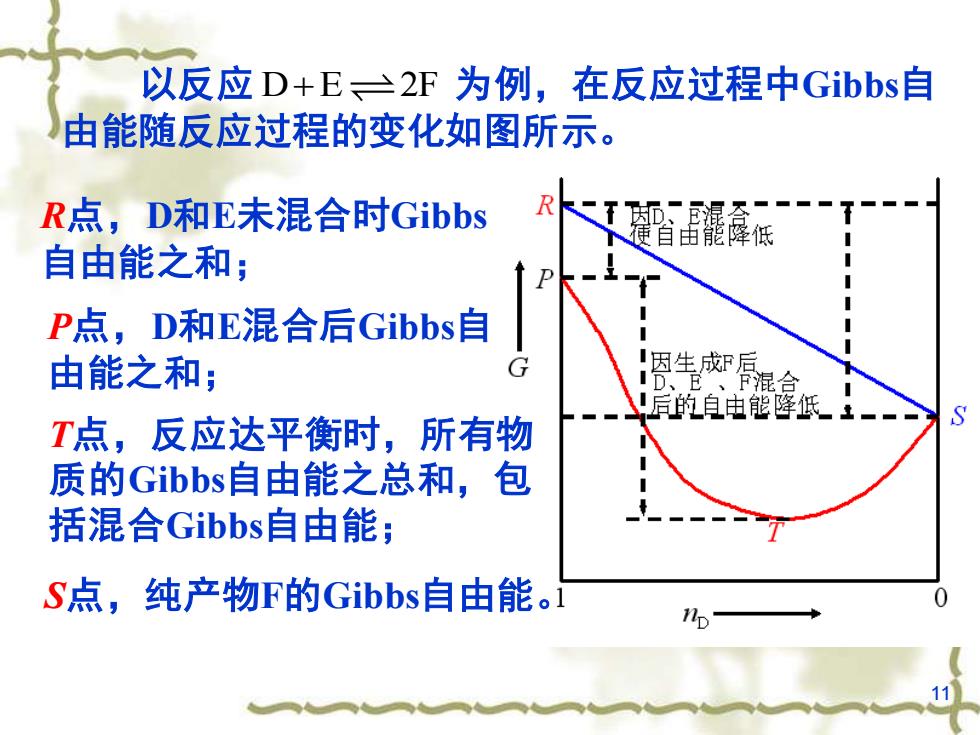
以反应D+E一2F为例,在反应过程中Gibbs自由能随反应过程的变化如图所示R食R点,D和E未混合时Gibbs便省由能降低自由能之和;P4P点,D和E混合后Gibbs自!因生成F后G由能之和;ID、E、F混合后的自电能降低1--ST点,反应达平衡时,所有物质的Gibbs自由能之总和,包括混合Gibbs自由能:S点,纯产物F的Gibbs自由能。0np
11 R点,D和E未混合时Gibbs 自由能之和; P点,D和E混合后Gibbs自 由能之和; T点,反应达平衡时,所有物 质的Gibbs自由能之总和,包 括混合Gibbs自由能; S点,纯产物F的Gibbs自由能。 以反应 为例,在反应过程中Gibbs自 由能随反应过程的变化如图所示。 D E 2F +
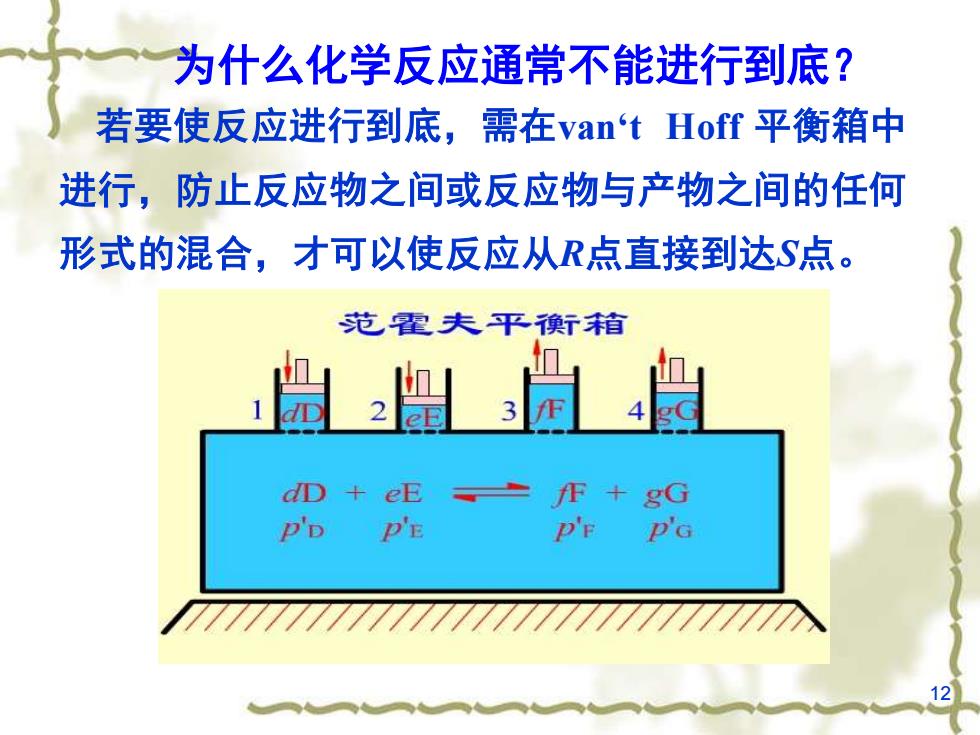
为什么化学反应通常不能进行到底?若要使反应进行到底,需在van'tHoff平衡箱中进行,防止反应物之间或反应物与产物之间的任何形式的混合,才可以使反应从R点直接到达S点。范霍夫平衡箱TF32dD+eEJF+gGP'EPDDFPG
12 为什么化学反应通常不能进行到底? 若要使反应进行到底,需在van‘t Hoff 平衡箱中 进行,防止反应物之间或反应物与产物之间的任何 形式的混合,才可以使反应从R点直接到达S点

2.化学反应的亲和势1922年,比利时热力学专家DeDonder首先引进了化学反应亲和势的概念。他定义化学亲和势A为:aGdefTasA=-A,Gm =-ZVBAlBB代入基本公式,得dG=-SdT+Vdp-Ads13
13 2.化学反应的亲和势 1922年,比利时热力学专家De Donder首先引进 了化学反应亲和势的概念。他定义化学亲和势A为: def , ( )T p G A − A G = −r m B B B = − d d d d G S T V p A = − + − 代入基本公式,得

VgB对于一般的化学反应0=BaGZVBHB =,Gm = -A=asBJT.PA>0反应正向进行A<0反应逆向进行A= 0反应达平衡
14 对于一般的化学反应 反应正向进行 反应达平衡 B B 0 B = B B r B m T p, G G A = = = − A> 0 A< 0 反应逆向进行 A= 0

s 6.2化学反应的平衡常数和等温方程式气相反应的平衡常数一化学反应的等温方程式液相中反应的平衡常数15
15 §6.2 化学反应的平衡常数和等温方程式 气相反应的平衡常数——化学反应的等温方程式 液相中反应的平衡常数