
第三章热力学第二定律不可能把热从低温物体传到高温物体,而不引起其它变化The Second Law of ThermodynamicsT
1 第三章 热力学第二定律 不可能把热从低 温物体传到高温 物体,而不引起 其它变化

第三章热力学第二定律$ 3.1自发变化的共同特征03.2热力学第二定律$3.3Carnot定理$ 3.4炳的概念$3.5Clausius不等式与滴增加原理$3.6热力学基本方程与T-S图$3.7摘变的计算$3.8滴和能量退降$3.9热力学第二定律的本质和滴的统计意义2
2 第三章 热力学第二定律 §3.1 自发变化的共同特征 §3.2 热力学第二定律 §3.3 Carnot定理 §3.4 熵的概念 §3.5 Clausius不等式与熵增加原理 §3.6 热力学基本方程与T-S图 §3.7 熵变的计算 §3.8 熵和能量退降 §3.9 热力学第二定律的本质和熵的统计意义

第三章热力学第二定律s 3.10Helmholtz和Gibbs自由能$3.11变化的方向与平衡条件$3.12△G的计算示例$3.13几个热力学函数间的关系$3.14热力学第三定律及规定炳*S:3.15绝对零度不能到达的原理*$ 3.16不可逆过程热力学简介*$ 3.17信息炳浅释3
3 第三章 热力学第二定律 §3.10 Helmholtz和Gibbs自由能 §3.11 变化的方向与平衡条件 §3.13 几个热力学函数间的关系 §3.12 G 的计算示例 §3.14 热力学第三定律及规定熵 *§3.15 绝对零度不能到达的原理 *§3.16 不可逆过程热力学简介 *§3.17 信息熵浅释

$3.1不可逆性自发变化的共同特征自发变化某种变化有自动发生的趋势,一旦发生就无需借助外力,可自动进行,这种变化称为自发变化。任何自发变化的逆过自发变化的共同特征一不可逆性程是不能自动进行的,且为热力学不可逆过程。例如:(1)焦耳热功当量中功自动转变成热:(3)热量从高温物体传入低温物体:(2)气体向真空膨胀;(4)浓度不等的溶液混合均匀;(5)锌片与硫酸铜的置换反应等它们的逆过程都不能自动进行。当借助外力,系统恢复原状后,会给环境留下不可磨灭的影响4
4 §3.1 自发变化的共同特征——不可逆性 自发变化 某种变化有自动发生的趋势,一旦发生就 无需借助外力,可自动进行,这种变化称为自发变化。 自发变化的共同特征—不可逆性 任何自发变化的逆过 程是不能自动进行的,且为热力学不可逆过程。例如: (1)焦耳热功当量中功自动转变成热; (2)气体向真空膨胀; (3)热量从高温物体传入低温物体; (4)浓度不等的溶液混合均匀;(5)锌片与硫酸铜的置换反应等 它们的逆过程都不能自动进行。当借助外力,系统 恢复原状后,会给环境留下不可磨灭的影响
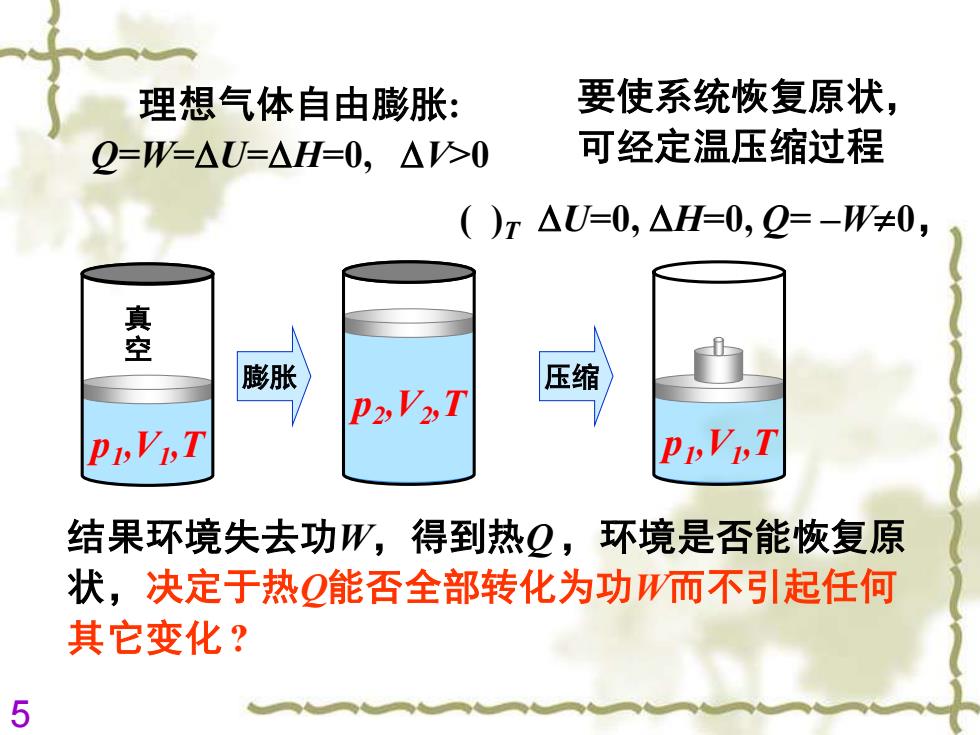
要使系统恢复原状理想气体自由膨胀:可经定温压缩过程Q-W-△U=△H-0, △V>0()T △U=0, △H=0,Q=-W+0,真空压缩膨胀P2,V2,TPi,Vi,TPi,Vi,T结果环境失去功W,得到热Q,环境是否能恢复原状,决定于热Q能否全部转化为功W而不引起任何其它变化?5
5 理想气体自由膨胀: Q=W=U=H=0, V>0 结果环境失去功W,得到热Q ,环境是否能恢复原 状,决定于热Q能否全部转化为功W而不引起任何 其它变化 ? 要使系统恢复原状, 可经定温压缩过程 真 空 p1 ,V1 ,T p2 ,V2 ,T p1 ,V1 ,T ( )T U=0, H=0, Q= –W0, 膨胀 压缩