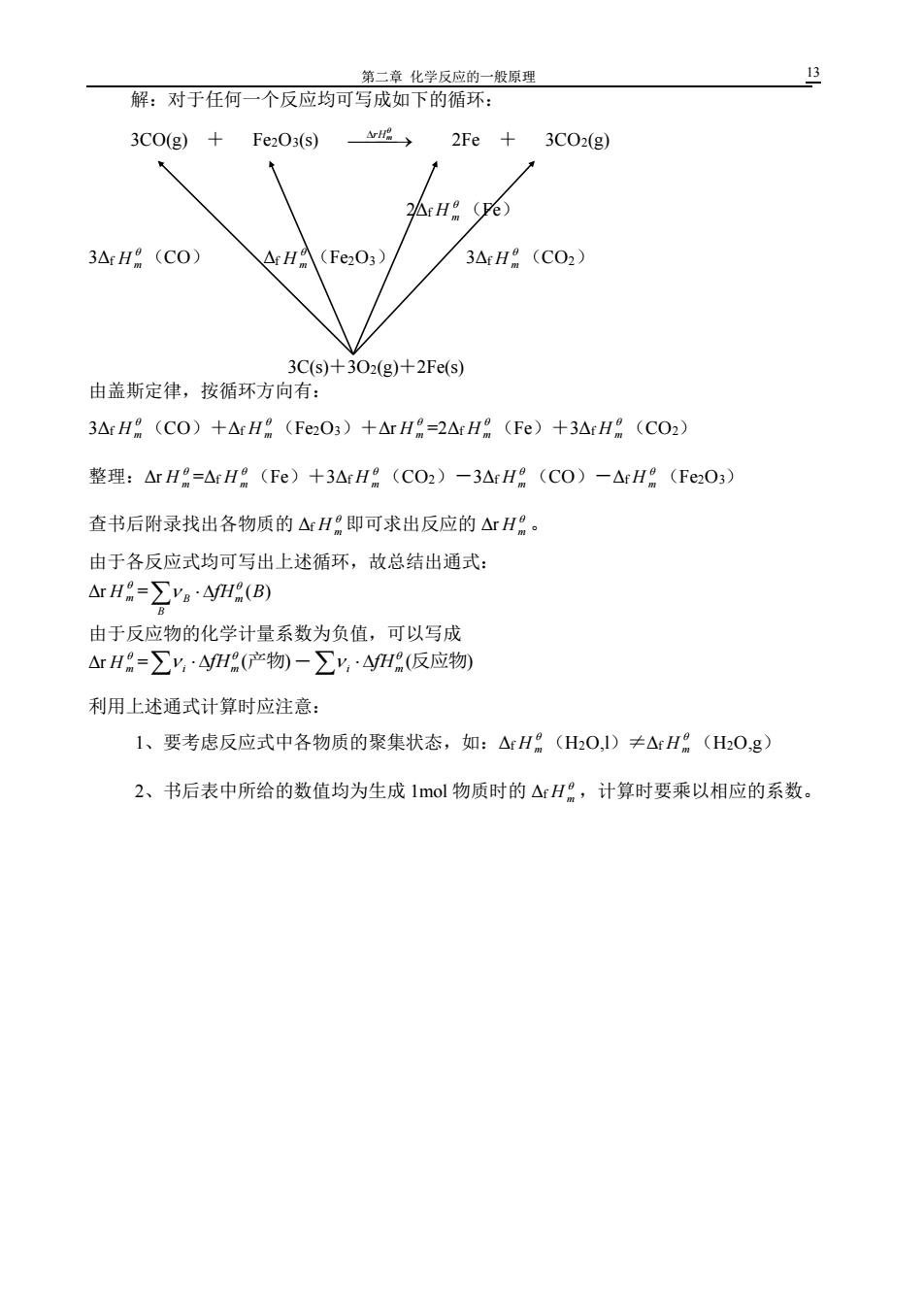
第二章化学反应的一般原理 解:对于任何一个反应均可写成如下的循环: 3C0(g)+ Fe2O3(s) 成→ 2Fe+3C02(g) Ar H (ve) 3△rH(CO) △rHA(Fe2O3) 3ArH (CO2) 3Cs)+302(g)+2Fe(s) 由盖斯定律,按循环方向有: 3ArH(C0)+△rH(Fe2O3)+△rH=2△rH(Fe)+3ArH8(CO2) 整理:△rH=△rH(FC)+3△rH(CO2)-3△rH:(CO)-△rH。(Fe2O3) 查书后附录找出各物质的△H即可求出反应的△rH:。 由于各反应式均可写出上述循环,故总结出通式: ArH=∑ya·4yHR(B) 由于反应物的化学计量系数为负值,可以写成 △rH=∑y,4H(产物)-∑y,·4H(反应物 利用上述通式计算时应注意: 1、要考虑反应式中各物质的聚集状态,如:△H(H2O,1)≠△H(HzO,g) 2、书后表中所给的数值均为生成1mol物质时的△rH,计算时要乘以相应的系数
第二章 化学反应的一般原理 13 解:对于任何一个反应均可写成如下的循环: 3CO(g) + Fe2O3(s) ⎯ ⎯→ rHm 2Fe + 3CO2(g) 2Δf H m (Fe) 3Δf H m (CO) Δf H m (Fe2O3) 3Δf H m (CO2) 3C(s)+3O2(g)+2Fe(s) 由盖斯定律,按循环方向有: 3Δf H m (CO)+Δf H m (Fe2O3)+Δr H m =2Δf H m (Fe)+3Δf H m (CO2) 整理:Δr H m =Δf H m (Fe)+3Δf H m (CO2)-3Δf H m (CO)-Δf H m (Fe2O3) 查书后附录找出各物质的 Δf H m 即可求出反应的 Δr H m 。 由于各反应式均可写出上述循环,故总结出通式: Δr H m = B B fHm (B) 由于反应物的化学计量系数为负值,可以写成 Δr H m = (产物) i m fH - (反应物) i m fH 利用上述通式计算时应注意: 1、要考虑反应式中各物质的聚集状态,如:Δf H m (H2O,l)≠Δf H m (H2O,g) 2、书后表中所给的数值均为生成 1mol 物质时的 Δf H m ,计算时要乘以相应的系数

50 §23化学反应的方向 、化学反应的自发性 1、自发反应(或过程):在一定条件下,不需要任何外力做功,就能自动进行的反应或 物理过程,称为自发反应式或自发过程。 如:水的流动、电流、0℃以下水的结冰。0℃以上冰的熔化,金属的生锈、及一些化学 反应,如:Zn十CuS04←→Cu十ZnS04 2、自发过程的推动力及限度 过程 自发方向 推动力 自发过程的最大 限度 水清 高水位低水位 △h △h-0 电流 高由位,低由位 气流 高气压一低气压 热传导 高温→低温 △T=0 化学反应 高自由焓→低自△G △G=0 由焓 结论: )自发变化的逆过程是非自发的 2)自发变化和非自发变化都是可能进行的,自发变化能自动进行,非自发变化需借 助一定方式的外部作用才能发生(如水泵、电解等)。 3)自发变化的最大限度是体系的平衡状态, 3、焓变与自发反应 自然界倾向于能量降低,如高位能→低位能、高温→低温,均属于能量降低,体系的能 量越低越稳定。 如:铁的生锈:3Fe(s)+202(g→Fe304(s) △rH2=-1118.4kJ·mol1 但单以能量降低为判据又不能解释如下事实:
第二章 化学反应的一般原理 14 §2-3 化学反应的方向 一、化学反应的自发性 1、自发反应(或过程):在一定条件下,不需要任何外力做功,就能自动进行的反应或 物理过程,称为自发反应式或自发过程。 如:水的流动、电流、0℃以下水的结冰。0℃以上冰的熔化,金属的生锈、及一些化学 反应,如 :Zn+CuSO4 ⎯→ Cu+ZnSO4 2、自发过程的推动力及限度 过程 自发方向 推动力 自 发 过程 的 最 大 限度 水流 高水位→低水位 Δh Δh=0 电流 高电位→低电位 ΔV ΔV=0 气流 高气压→低气压 Δp Δp=0 热传导 高温→低温 ΔT ΔT=0 化学反应 高 自 由焓 → 低 自 由焓 ΔG ΔG=0 结论: 1) 自发变化的逆过程是非自发的。 2) 自发变化和非自发变化都是可能进行的,自发变化能自动进行,非自发变化需借 助一定方式的外部作用才能发生(如水泵、电解等)。 3) 自发变化的最大限度是体系的平衡状态, 3、 焓变与自发反应 自然界倾向于能量降低,如高位能→低位能、高温→低温,均属于能量降低,体系的能 量越低越稳定。 如:铁的生锈:3Fe(s)+2O2(g)—→Fe3O4(s) Δr H m =-1118.4kJ·mol-1 但单以能量降低为判据又不能解释如下事实:

第二章化学反应的一般原理 H20S25C→H200 △rHR>0 KNO3(S)→K++NO △rH=35kJ·mol N205(g)→2N02(g)+,02(g) △rH2=56.7kJ·mol 还有些反应的自发性与温度有关。 如:CaC0ss)→Ca0(s)+C02(g) 此反应常温下不自发,而在850℃以上时,则能自发进行。 由此可见:用△H。<0作为反应自发与否的判断标准不全面,不具有普遍意义。 二、混乱度与自发方向 自然界的另一自发倾向一一混乱度增大。 贵资的费货品内不行色球的准外是物时布自于假发大 1、熵(S) 体系内微观粒子运动的混乱程度,在热力学中用一个新的物理量熵(S)来表示,熵是反 映体系内部质点混乱程度的物理量。 )S是状态函数,体系状态一定时,就有确定的熵值,体系的混乱度越大,熵值越 2)熵有绝对数值。0K时完整的晶态纯物质S0=0,:此时排列最有序其它温度下 物质的绝对熵值为ST=ST一S0=△S。附录三中有各物质的S°(25℃,100KPa)。 3)影响熵值大小的因素: 聚集状态:SBg>S°B>SBS) 在定性判断一个化学反应是熵增还是嫡减时,通常考虑为气体分子数增大的方向 是嫡增过程。 温度:同一物质时,T>2则S”T>S卫 分子结构:分子量相近,结构越复杂,熵越大。对称性越好,熵越小。 如:S(C2HsOH)>S(CH-O-CH) 分子量:结构相近,分子量越大,熵越大。S°>S°m>S°H0>S° 2、标准摩尔反应熵变(△S)的计算 △rS的计算与由△H:计算△rH的形式相同。 △rS=∑ySg(产物)-∑yS(反应物)减4s=∑'aS2(B) 1)T对△rS的影响不大,在温度变化不是很大时,可用△rS(298)代替△rS(T) 2)稳定单质的S(298)≠0,查表时应注意
第二章 化学反应的一般原理 15 H2O(s) ⎯ ⎯C→ o 25 H2O(l) Δr H m >0 KNO3(s) ⎯→ K ++NO3 - Δr H m =35 kJ·mol-1 N2O5(g) ⎯→ 2NO2(g)+ 2 1 O2(g) Δr H m =56.7 kJ·mol-1 还有些反应的自发性与温度有关。 如:CaCO3(s) ⎯→ CaO(s)+CO2(g) 此反应常温下不自发,而在 850℃以上时,则能自发进行。 由此可见:用 Δr H m <0 作为反应自发与否的判断标准不全面,不具有普遍意义。 二、混乱度与自发方向 自然界的另一自发倾向——混乱度增大。 如:气体的扩散、物质的溶解、容器内不同颜色球的排列,抛掷物体时都倾向于混乱度增大, 要使其规则排列,则需对其做功。 1、 熵(S) 体系内微观粒子运动的混乱程度,在热力学中用一个新的物理量熵(S)来表示,熵是反 映体系内部质点混乱程度的物理量。 1) S 是状态函数,体系状态一定时,就有确定的熵值,体系的混乱度越大,熵值越 大。 2) 熵有绝对数值。0 K 时完整的晶态纯物质 S0=0,∵此时排列最有序其它温度下 物质的绝对熵值为 ST=ST-S0=△S。附录三中有各物质的 S (25℃,100KPa)。 3)影响熵值大小的因素: 聚集状态: S B(g)> S B(l)> S B(s) 在定性判断一个化学反应是熵增还是熵减时,通常考虑为气体分子数增大的方向 是熵增过程。 温度:同一物质时,T1>T2,则 S T1> S T2 分子结构:分子量相近,结构越复杂,熵越大。对称性越好,熵越小。 如: S (C2H5OH)> S (CH3-O-CH3) 分子量:结构相近,分子量越大,熵越大。 S HI> S HBr> S HCl> S HF 2、 标准摩尔反应熵变(Δr m S )的计算 Δr m S 的计算与由 Δf H m 计算 Δr H m 的形式相同。 Δr m S = i m S (产物)- i m S (反应物)或 Δr m S = B B m S (B) 1) T 对 Δr m S 的影响不大,在温度变化不是很大时,可用 Δr m S (298)代替 Δr m S (T) 2) 稳定单质的 m S (298)≠0,查表时应注意