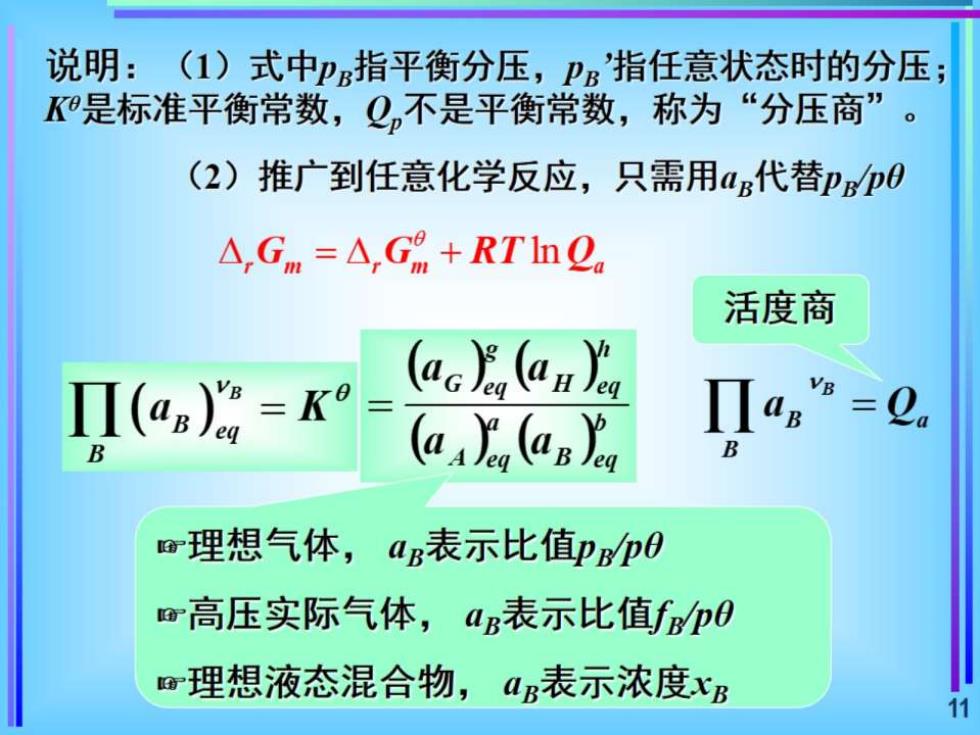
说明:(1)式中p指平衡分压,P'指任意状态时的分压; K是标准平衡常数,Q,不是平衡常数,称为“分压商”。 (2)推广到任意化学反应,只需用a代替pBp0 △,Gm=△,G%+RTh2。 活度商 (ag=K°= (ac (an B (a.(an aa B r理想气体,aB表示比值即Bp0 m高压实际气体,aB表示比值fpO 理想液态混合物,aB表示浓度xB 11

(3)可利用范特霍夫等温方程判别化学反应的方向和 限度。 △,Gm=△,G+RThQ =-RTIn K+RTnQ。 当Q。<K时,4,Gm<0,反应正向自发 当Q.>K时,4,Gm>0,反应逆向自发 m当Q。=K时,4,Gm=0,反应达平衡 pl15例1 12

54.2反应的标准吉布斯自由能变化4G,9 一、4,Gm和4Gme的关系 二、标准生成吉布斯自由能G9 三、反应的4G⊙和Ke的求算 13

一、4,Gm和4,Gme的关系 △,Gm=△,G9+RTln2。 14,Gm6=2/49: ()1pe一定,4,Gnme是一常数 AGm->VBLB ()p'4,Gm不是常数,与Q有关 24,Gm可指示反应自发进行的方向: 4,Gm⊙即K©可指示反应的限度,一般情况下不能 指示反应自发方向。 14

例如 1/2N2(g)+3/2H2(g) NH;(g) 4,Gme(673K)=24.2 kJ-mol-1>0, (不能指示方向) 当Q。<K94,Gm<0正向自发 Q。=K94,Gm=0平衡 15