
反应等温方程 反应△G9 四 经验平衡常数 免缘平测 平衡常数测定 温度对K螺影响 其它因素的影响 平衡组成计算 习题课

§4.1化学反应的方向和限度 一、化学反应的限度 二、反应系统的Gibbs自由能 三、化学反应的平衡常数和等温方程

一、化学反应的限度 对于反应:Reactants forward Products backward 当反应达到平衡态时,具有下列特征: 1.系统中各物质的数量不再随时间而改变。即反应 进度达到极限值一g(反应的限度)。 2.宏观上看反应停止了,实际上达到动态平衡。 rate(forward)=rate(backward) 3.平衡不受催化剂的影响 4.反应条件不仅能影响平衡,还能改变反应方向。 如:加压能使石墨金刚石

二、反应系统的Gibbs自由能 任意化学反应:()zp,W=0时,反应方向和限 度的判据为: (dGzp=ΣsdnB=∑ggd5≤0 其中d5为反应的进度。d5=dBB 〔<0正向自发: 上式可整理为 -0平衡; >0逆向自发 反应系统的吉布斯自由能G如何随ξ变化呢?
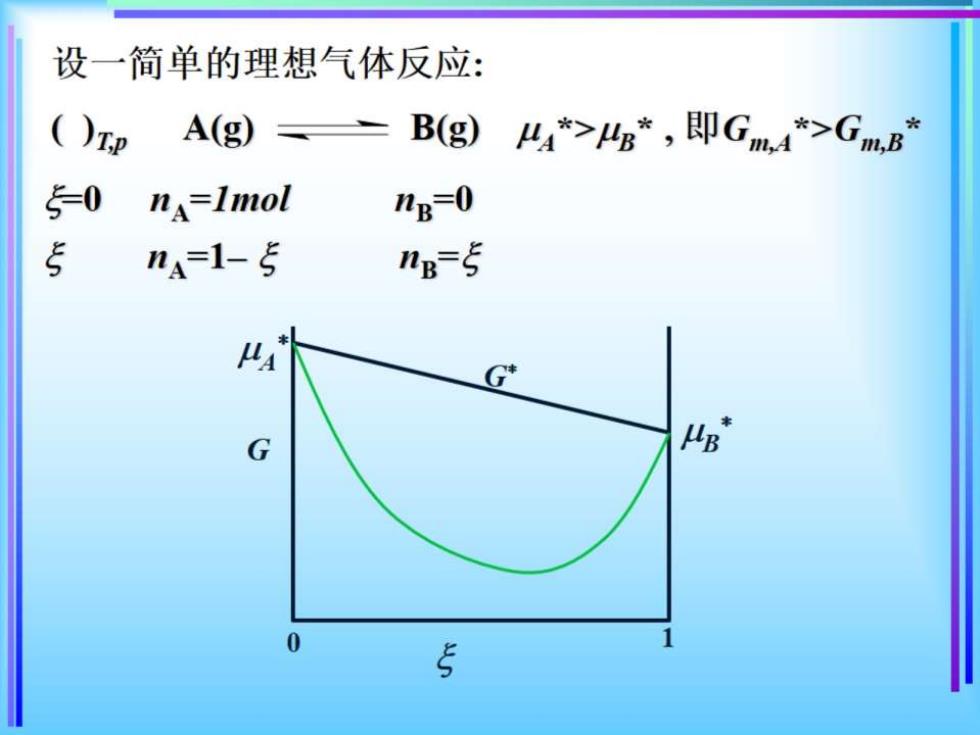
设一简单的理想气体反应: ()印 A(g) B(g) 44*>4g*,即Gm4*>GmB* 5=0 nA=Imol ng-0 5 na-1-5 ng=5 G* G 0 5