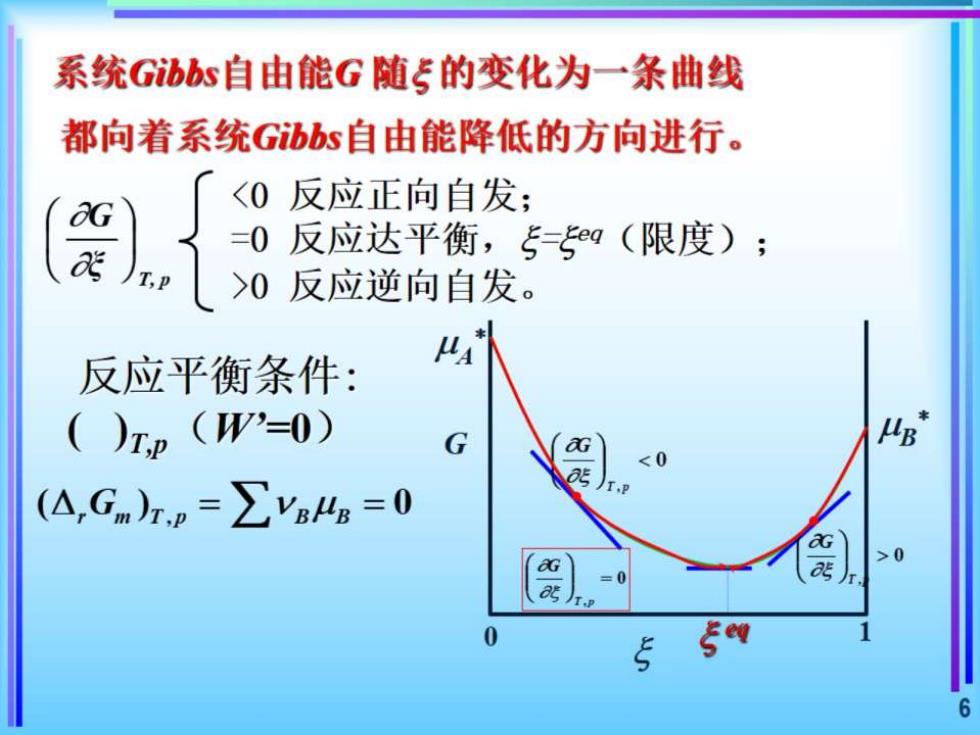
系统Gibbs自由能G随5的变化为一条曲线 都向着系统Gibbs自由能降低的方向进行。 <0反应正向自发; =0反应达平衡,5®g(限度); >0反应逆向自发。 反应平衡条件: ()rp(W'=0) MB" (△,Gm)rp=∑ys4g=0 >0 G 6

三、化学反应的平衡常数和等温方程 假设有理想气体化学反应aA+bB 二gG+hH 当反应达到平衡g4G+ha=a44+bB 混合理想气体B的化学势表达式为: Cpm=gD+RTn号 则上式可写为 +aRTin bTn

即 Pa n RT (g8+h唱-a-bg) 式中,pB为B物质在平衡时的分压。因为等式右边 各项都只是T的函数,T一定时,等式右边为一常 数。所以 =常数=K 08 o. p 标准平衡常数,一定温度 时为一定值,量纲为1 8

n RT (g8+h日-a4-bg) 如果令8呢+h4唱-a4-b4哈=△,G 则 反应的标准吉布斯函数 变化,指反应物和产物 均处于标准态时,产物 △,GR=-RTIn K 的吉布斯函数与反应物 的吉布斯函数总之差 9
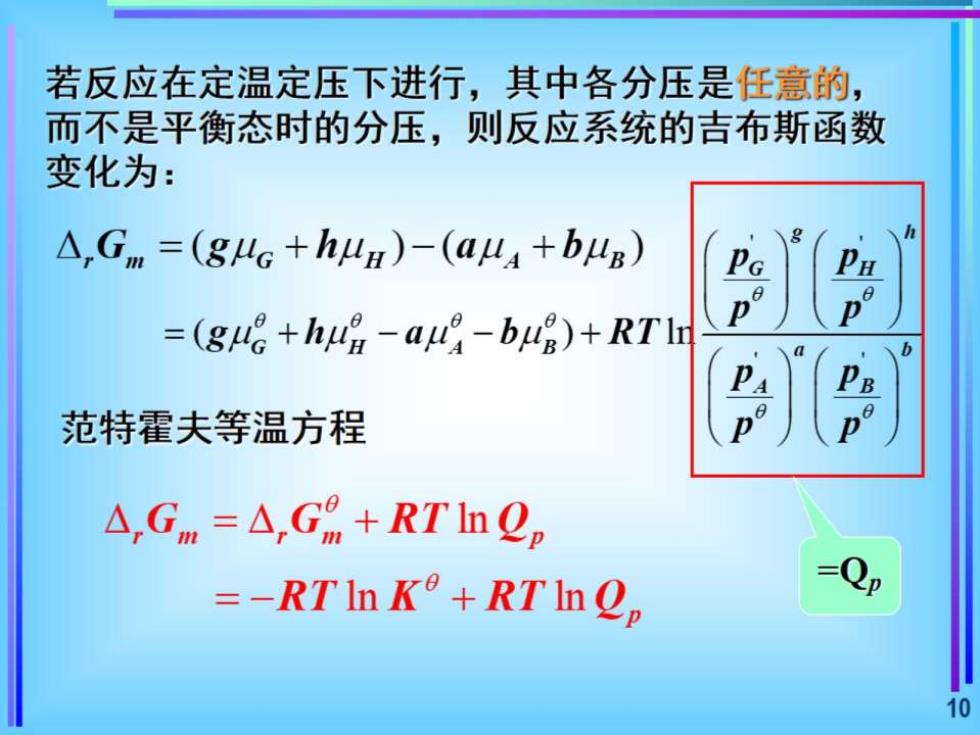
若反应在定温定压下进行,其中各分压是任意的, 而不是平衡态时的分压,则反应系统的吉布斯函数 变化为: △,Gm=(gG+hua)-(a44+bB) 0 =(ge+h日-au-b4g)+RTl 范特霍夫等温方程 △,Gm=△,Gm+RTln2。 =-RTIn K°+RTIQ, Qp 10