
餐山东理工大窖C化学化工学院RSHANDONG UNIVERSITY OFTECHNOLOGY分析化学Analytical Chemistry福主讲老师:ST联系方式:
1 分析化学 Analytical Chemistry 主讲老师: 联系方式:

山东理工大客第五章酸碱滴定法SHANDONGUNIVERSITY OFTECHNOLOGYacid-base titration本章主要内容:1、酸碱质子理论:2、酸碱平衡体系中各型体的分布;3、酸碱平衡体系pH值的计算;4、酸碱缓冲溶液;5、酸碱指示剂;6、酸碱滴定基本原理:7、终点误差计算:8、酸碱滴定法的应用
2 2 第五章 酸碱滴定法 (acid-base titration) 本章主要内容: 1、酸碱质子理论; 2、酸碱平衡体系中各型体的分布; 3、酸碱平衡体系pH值的计算; 4、酸碱缓冲溶液; 5、酸碱指示剂; 6、酸碱滴定基本原理; 7、终点误差计算; 8、酸碱滴定法的应用

山东理工大客概述SHANDONGUNIVERSITYOFTECHNOLOGY酸碱滴定法是基于酸碱反应的滴定分析方法其理论基础为酸碱平衡理论S5.1溶液中的酸碱反应与平衡R一、活度与浓度活度:在化学反应中表现出来的有效浓度,通常用aai = Yi Ci表示活度系数表达实际溶溶液无限稀时:=1液和理想溶液之间的差中性分子:=1异大小溶剂活度:a=1
3 3 概述 酸碱滴定法是基于酸碱反应的滴定分析方法 其理论基础为酸碱平衡理论 §5.1 溶液中的酸碱反应与平衡 一、 活度与浓度 活度:在化学反应中表现出来的有效浓度,通常用a 表示 ai = gi ci 溶液无限稀时: g =1 中性分子: g =1 溶剂活度: a =1 活度系数γi表达实际溶 液和理想溶液之间的差 异大小
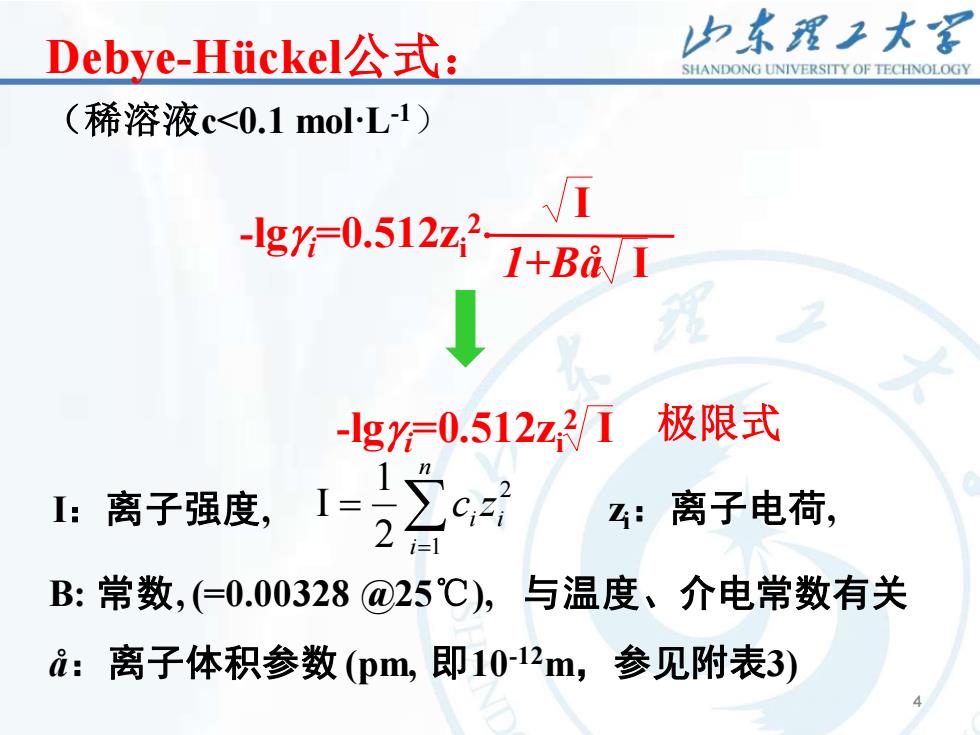
山东理工大客Debye-Hickel公式:SHANDONGUNIVERSITYOFTECHNOLOGY(稀溶液c<0.1 mol:L-1)/?-IgY=0.512z1+Ba/1强极限式-IgY=0.512z2/1nZ2=C,z,I:离子强度,z:离子电荷2i=1B: 常数,(=0.00328 @25℃),与温度、介电常数有关ai:离子体积参数(pm,即10-12m,参见附表3)
4 4 Debye-Hückel公式: (稀溶液c<0.1 mol·L-1) -lgg i=0.512zi 2 I 1+Bå I -lgg i=0.512zi 2 I 极限式 I:离子强度, 2 2 1 1 I i n i i c z = = zi:离子电荷, B: 常数, (=0.00328 @25℃), 与温度、介电常数有关 å:离子体积参数 (pm, 即10-12m,参见附表3)

山东理工大客酸碱理论简介二、SHANDONGUNIVERSITYOFTECHNOLOGY1、十七世纪中叶,Boyle原始酸碱概念;2、1889年,瑞典S.A.Arrhenius,电离理论;3、1905年,美国E.C.Franklin,溶剂理论;4、1923年,丹麦J.N.Bonstead-英T.MLowry,质子理论;5、1923年,美国G.N.Lewis,电子理论;6、其他:正负性理论;给体受体理论;软硬酸碱理论..由浅到深,由感性到理性,由低级到高级,发展成为现代酸碱理论
5 5 二、 酸碱理论简介 1、十七世纪中叶,Boyle原始酸碱概念; 2、1889年,瑞典S. A. Arrhenius,电离理论; 3、1905年,美国E. C. Franklin,溶剂理论; 4、1923年,丹麦J. N. Bonstead-英T. M. Lowry,质子理论; 5、1923年,美国G. N. Lewis,电子理论; 6、其他:正负性理论;给体受体理论;软硬酸 碱理论. . 由浅到深,由感性到理性,由低级到高级,发 展成为现代酸碱理论