
微判断(1)在NaCI中,只存在Na+和C的静电吸引作用。 (×) (2)离子键是阴、阳离子间的相互吸引作用。(X) (3)熔融状态下能导电的物质一定是离子化合物。(X) (4)金属原子在化学反应中只能失去电子,所以只能形成离 子键。(X) (⑤)原子序数为12和9的原子所对应的元素可形成离子化合 物。(√) (⑥)仅由非金属元素组成的物质中可能含有离子键。(√)
导航 微判断(1)在NaCl中,只存在Na+和Cl-的静电吸引作用。 ( ) (2)离子键是阴、阳离子间的相互吸引作用。( ) (3)熔融状态下能导电的物质一定是离子化合物。( ) (4)金属原子在化学反应中只能失去电子,所以只能形成离 子键。( ) (5)原子序数为12和9的原子所对应的元素可形成离子化合 物。( ) (6)仅由非金属元素组成的物质中可能含有离子键。( ) × × × × √ √

导航 二、电子式和用电子式表示离子化合物的形成过程 1.电子式。 在元素符号周围用“”或“X”来表示 的式子。 如,Na的电子式为 ,Mg的电子式为 C的电子式为 2.用电子式表示离子化合物的形成过程。 NaCI的形成过程:
导航 二、电子式和用电子式表示离子化合物的形成过程 1.电子式。 在元素符号周围用“·”或“×”来表示 原子的最外层电子 (价电子) 的式子。 如,Na的电子式为 Na× ,Mg的电子式为 ×Mg× , Cl的电子式为 。 2.用电子式表示离子化合物的形成过程。 NaCl 的形成过程:
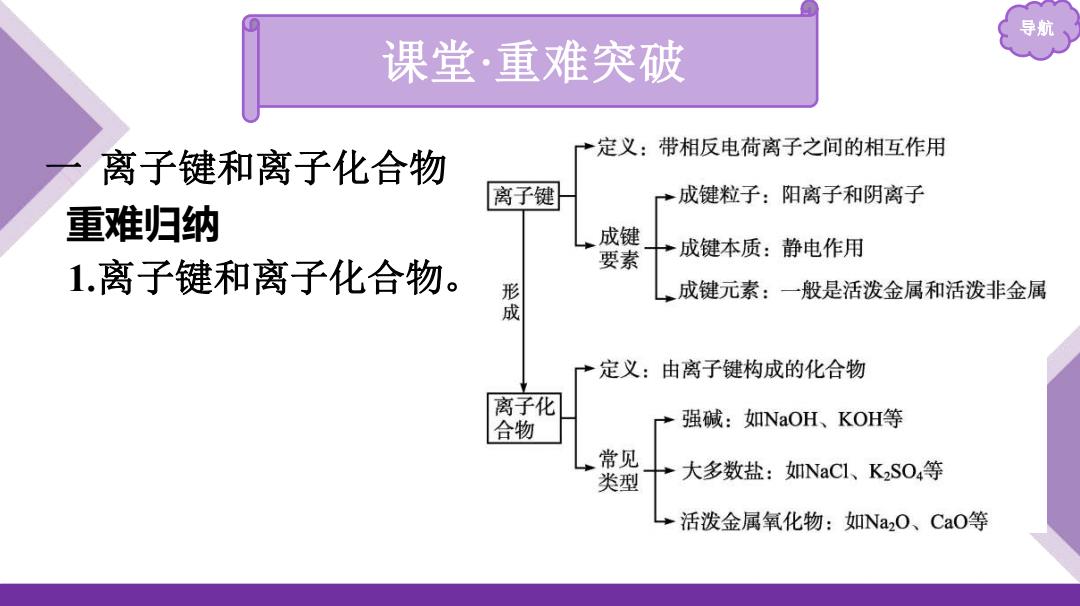
导航 课堂·重难突破 →定义:带相反电荷离子之间的相互作用 离子键和离子化合物 离子键 成键粒子:阳离子和阴离子 重难归纳 成键 要素 →成键本质:静电作用 1.离子键和离子化合物。 形 成键元素:一般是活泼金属和活泼非金属 →定义:由离子键构成的化合物 离子化 合物 强碱:如NaOH、KOH等 常见 类型 →大多数盐:如NaC1、KSO4等 活泼金属氧化物:如Na2O、CaO等
导航 一 离子键和离子化合物 重难归纳 1.离子键和离子化合物。 课堂·重难突破
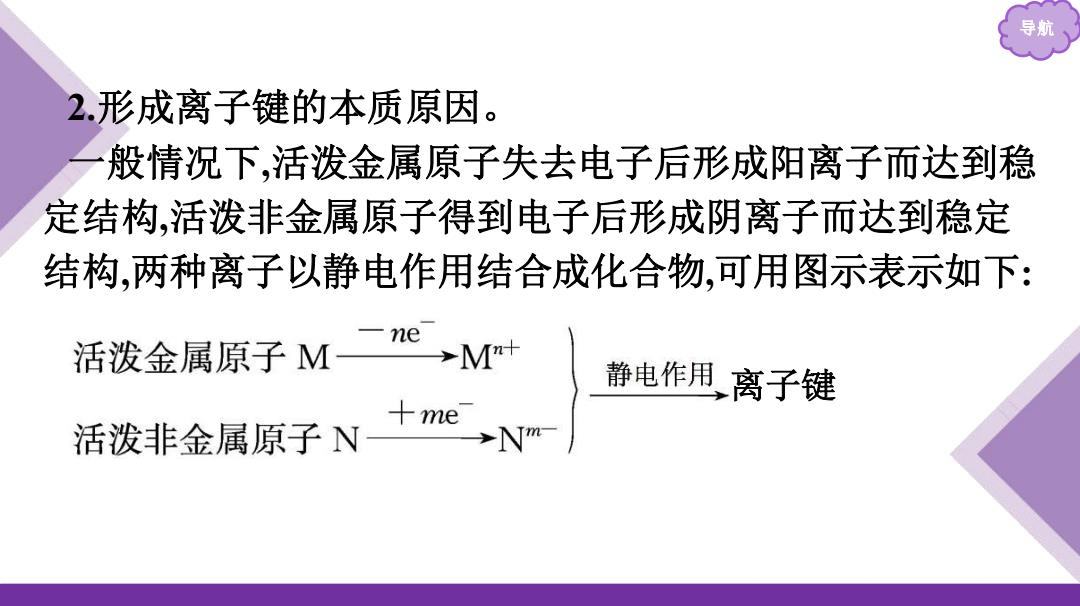
导期 2.形成离子键的本质原因。 般情况下,活泼金属原子失去电子后形成阳离子而达到稳 定结构,活泼非金属原子得到电子后形成阴离子而达到稳定 结构,两种离子以静电作用结合成化合物,可用图示表示如下: ne 活泼金属原子M 静电作用,离子键 活泼非金属原子N+meNm
导航 2.形成离子键的本质原因。 一般情况下,活泼金属原子失去电子后形成阳离子而达到稳 定结构,活泼非金属原子得到电子后形成阴离子而达到稳定 结构,两种离子以静电作用结合成化合物,可用图示表示如下: 离子键