
第三章氧化还原反应 [引言]什么是氧化还原反应? 第一节基本概念 [认识过程 氧化一结合氧的过程 还原失去氧的过程 氧化失去电子过程 还原一得电子的过程 [问题如何认识反应:H2+C2→2HC1 一、氧化数(态、值) 1、定义:元素的一个原子在纯化学物种中的特定形 式电荷数。 特定性 “特定形式电荷数”服从下列规则
第三章 氧化还原反应 [引言]什么是氧化还原反应? 第一节 基本概念 [认识过程] 氧化——结合氧的过程 还原——失去氧的过程 氧化——失去电子过程 还原——得电子的过程 [问题]如何认识反应:H2+Cl22HCl 一、氧化数(态、值) 1、定义:元素的一个原子在纯化学物种中的特定形 式电荷数。 特定性—— “特定形式电荷数” 服从下列规则

(1)纯化学物种的实际电荷数等于其组成元素的氧化数之和 (2)一般情况下,元素在化合状态中的氧化数规定不为零 处于周期表左下方元素的氧化数为+,右上方的为-; (3)化合状态,F为-1;大多数含氧化合物中0为-2,H除 金属氢化物外,为+1; (4)元素在分子间化合物中的氧化态与其在对应小分子中的 一样。 [注]①上述为计算元素氧化数的原则;规定将正负号置于 数的前面。 ②氧化态亦简称价态,但它与化合价概念不同。 二、氧化还原反应 —对立的统一体 定义:某些元素的氧化数发生改变的反应。 氧化—氧化数升高的过程 还原—氧化数降低的过程
⑴纯化学物种的实际电荷数等于其组成元素的氧化数之和 ⑵一般情况下,元素在化合状态中的氧化数规定不为零, 处于周期表左下方元素的氧化数为+,右上方的为-; ⑶化合状态,F为-1;大多数含氧化合物中O为-2,H除 金属氢化物外,为+1; ⑷元素在分子间化合物中的氧化态与其在对应小分子中的 一样。 [注] ①上述为计算元素氧化数的原则;规定将正负号置于 数的前面。 ②氧化态亦简称价态,但它与化合价概念不同。 二、氧化还原反应——对立的统一体 定义:某些元素的氧化数发生改变的反应。 氧化——氧化数升高的过程 还原——氧化数降低的过程

注]氧化剂、还原剂、氧化、还原、被氧化、被还原、氧 化数变化、电子得失等概念及关系。 三、氧化还原反应方程式配平(自学) 原则:质量守恒、电量守恒。(氧化数法和离子电子法) [规律]—介质产物的一般规律 酸中出水,碱中出水,水中出酸或碱 反应物多氧 酸性加H中→H2O 碱性加H20→OH 反应物少氧 酸性加H2O→H 碱性加OH→H2O 第二节电极电势(位) [引言]引起氧化数变化的原因是什么?
[注] 氧化剂、还原剂、氧化、还原、被氧化、被还原、氧 化数变化、电子得失等概念及关系。 三、氧化还原反应方程式配平(自学) 原则:质量守恒、电量守恒。(氧化数法和离子电子法) [规律]——介质产物的一般规律 酸中出水,碱中出水,水中出酸或碱 反应物多氧—— 酸性 加H+ → H2O 碱性 加H2O → OH- 反应物少氧—— 酸性 加H2O → H+ 碱性 加OH- → H2O 第二节 电极电势(位) [引言]引起氧化数变化的原因是什么?

一 氧化还原电对 一个氧化还原反应包含氧化、还原两过程,故拆分为两 半反应。例Zn+Cu2+→Zn2++Cu 氧化反应:Zn→Zn2++2e 还原反应:Cu2++2e→Cu 每个半反应表明了某元素高低不同氧化态之间的转化关系 [氧化型凹+ne一[还原型] 正向为还原,逆向为氧化,它们彼此依存,相互转化 关系与共轭酸碱对一样。称为氧化还原电对(电对)。 电对符号:[氧化型凹/还原型] [小结]每个氧化还原反应至少有两个电对,分别称为氧化 剂电对和还原剂电对。 氧化剂 氧化剂电对的氧化型充当 还原剂—还原剂电对的还原型充当
一、氧化还原电对 一个氧化还原反应包含氧化、还原两过程,故拆分为两 半反应。例 Zn + Cu2+ Zn2+ + Cu 氧化反应: Zn Zn2+ + 2e 还原反应: Cu2+ +2e Cu 每个半反应表明了某元素高低不同氧化态之间的转化关系 [氧化型] + ne [还原型] 正向为还原,逆向为氧化,它们彼此依存,相互转化, 关系与共轭酸碱对一样。称为氧化还原电对(电对)。 电对符号:[氧化型]/[还原型] [小结]每个氧化还原反应至少有两个电对,分别称为氧化 剂电对和还原剂电对。 氧化剂——氧化剂电对的氧化型充当 还原剂——还原剂电对的还原型充当
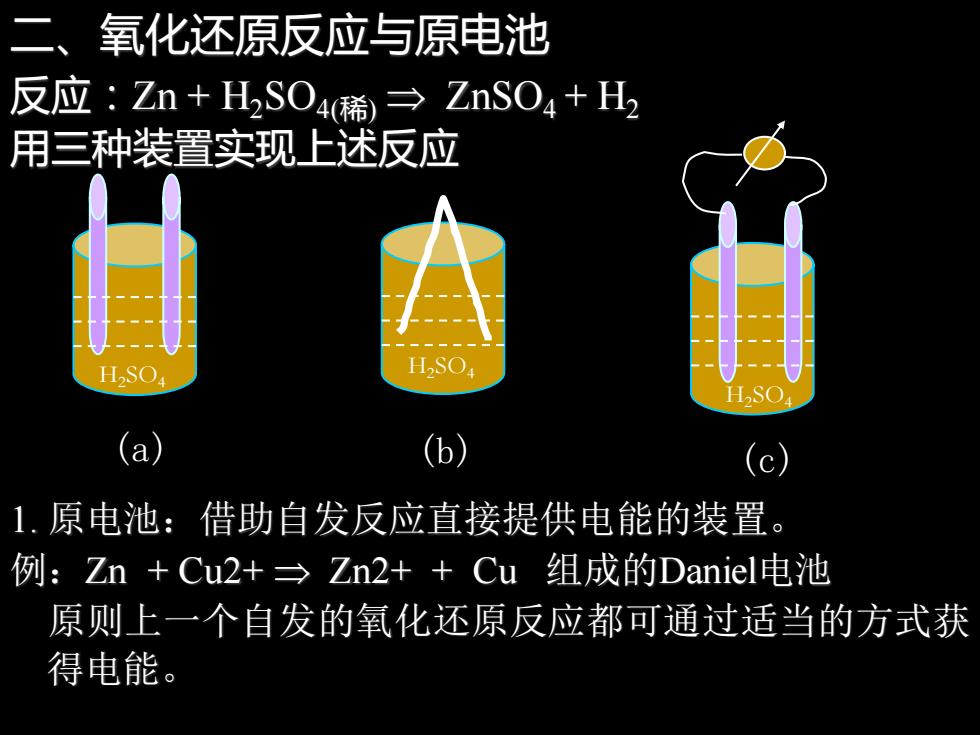
二、氧化还原反应与原电池 反应:Zn+H2SO4稀→ZnSO4+H 用三种装置实现上述反应 (a) (b (c) 1.原电池:借助自发反应直接提供电能的装置。 例:Zn+Cu2+→Zn2++Cu组成的Daniel电池 原则上一个自发的氧化还原反应都可通过适当的方式获 得电能
二、氧化还原反应与原电池 反应:Zn + H2SO4(稀) ZnSO4 + H2 用三种装置实现上述反应 H2SO4 (a) H2SO4 (b) H2SO4 (c) 1. 原电池:借助自发反应直接提供电能的装置。 例:Zn + Cu2+ Zn2+ + Cu 组成的Daniel电池 原则上一个自发的氧化还原反应都可通过适当的方式获 得电能