
Chapter18非金属元素小结 18.1非金属单质的结构和性质 18.2分子型氢化物 18.3含氧酸 18.4非金属含氧酸盐的某些性质 18.5P区元素的次级周期性
Chapter 18 非金属元素小结 18.1 非金属单质的结构和性质 18.2 分子型氢化物 18.3 含氧酸 18.4 非金属含氧酸盐的某些性质 18.5 P区元素的次级周期性
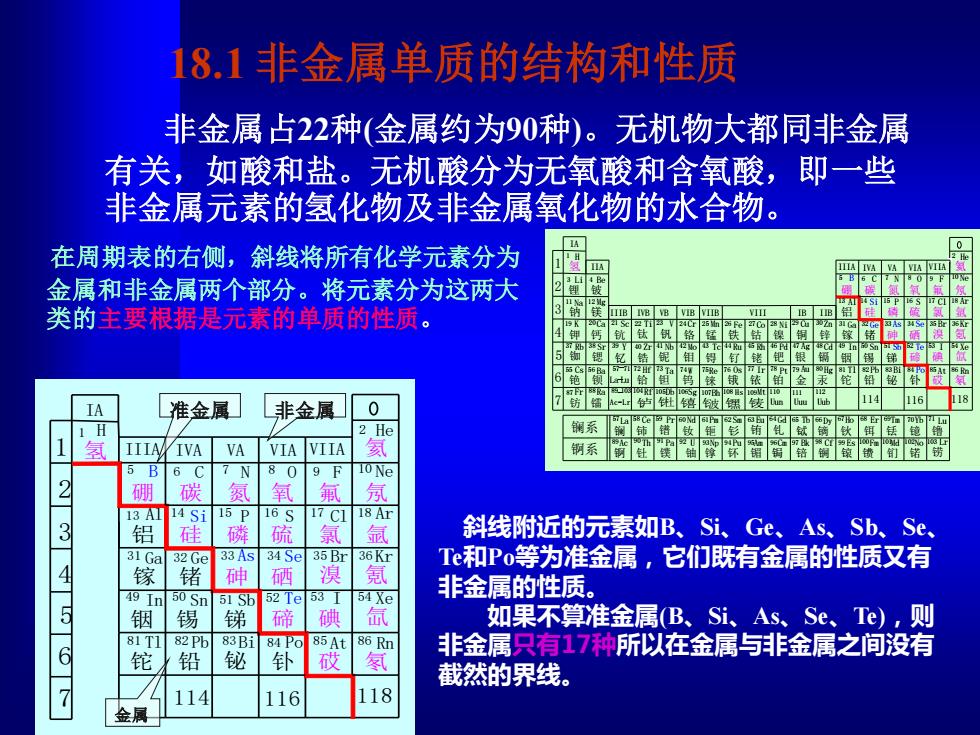
18.1非金属单质的结构和性质 非金属占22种(金属约为90种)。无机物大都同非金属 有关,如酸和盐。无机酸分为无氧酸和含氧酸,即一些 非金属元素的氢化物及非金属氧化物的水合物。 在周期表的右侧,斜线将所有化学元素分为 金属和非金属两个部分。将元素分为这两大 类的主要根据是元素的单质的性质。 IIB IV8 VB 7 IA 准金属 非金属 0 He IIIA IVA VA VIAVIIA 809F o Ne 硼 碳 氧 氟 氖 137A 4 Si 15P 16S 17C118Ar 铝 硅 磷 硫 氯 氩 斜线附近的元素如B、Si、Ge、As、Sb、Se、 31 Ga 32 Ge 33 As 34 Se 35 Br Tc和Po等为准金属,它们既有金属的性质又有 镓 锗 砷 漠 氪 49 Ir 50S7 52 Te53 T 54Xe 非金属的性质。 锡 锑 碲 碘 氙 如果不算准金属B、Si、As、Se、Te),则 81T1 82 Pb 83B1 84 Po 85At 86 Rn 非金属只有17种所以在金属与非金属之间没有 铊 铅 铋 砹 截然的界线。 114 116 118 金属
18.1 非金属单质的结构和性质 非金属占22种(金属约为90种)。无机物大都同非金属 有关,如酸和盐。无机酸分为无氧酸和含氧酸,即一些 非金属元素的氢化物及非金属氧化物的水合物。 斜线附近的元素如B、Si、Ge、As、Sb、Se、 Te和Po等为准金属,它们既有金属的性质又有 非金属的性质。 如果不算准金属(B、Si、As、Se、Te),则 非金属只有17种所以在金属与非金属之间没有 截然的界线。 114 116 118 1 2 3 4 5 6 7 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 镧系 锕系 钫 镭 铌 钽 银 金 镉 汞 铟 铊 锡 铅 锑 铋 碲 钋 砹 氡 碘 氙 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 铷 铯 锶 钡 钇 锆 铪 钼 钨 锝 铼 钌 铑 钯 锇 铱 铂 氢 锂 氦 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 氪 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn IB IA IIA IIIA IVA VA VIA VIIA IIIB IVB VB VIB VIIB VIII IIB Rf Db Sg Bh H s Mt Ac-Lr Uun Uuu Uub La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Cs Fr Sr Ba Ra Y La-Lu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 57 89-103 -71 1 2 3 4 5 6 7 氢 IA 1 H 114 116 118 铟 铊 锡 铅 锑 铋 碲 钋 砹 氡 碘 氙 氦 硼 碳 氮 氧 氟 氖 铝 硅 磷 硫 氯 氩 镓 锗 砷 硒 溴 氪 In Sn Sb Te I Xe Tl Pb Bi Po At Rn IIIA IVA VA VIA VIIA He B C N O F Ne Al Si P S Cl Ar Ga Ge As Se Br Kr 2 5 6 7 8 9 10 13 14 15 16 17 18 31 32 33 34 35 36 49 50 51 52 53 54 81 82 83 84 85 86 准金属 非金属 金属 在周期表的右侧,斜线将所有化学元素分为 金属和非金属两个部分。将元素分为这两大 类的主要根据是元素的单质的性质

18.1.1非金属单质的结构和物理性质 自学要求: 1、了解非金属单质中的共价键数为8-N(H2为2-N)。 2、第2周期中的0、N为什么易形成多重键?第3、4 周期的S、Se、P、As等则易形成单键? 3、非金属单质按其结构和性质大致可分为哪三类? 4、掌握单质C2、S、P、S和B与NaOH反应的方程
18.1.1 非金属单质的结构和物理性质 自学要求: 1、了解非金属单质中的共价键数为8-N(H2为2-N)。 2、第2周期中的O、N为什么易形成多重键?第3、4 周期的S、Se、P、As等则易形成单键? 3、非金属单质按其结构和性质大致可分为哪三类? 4、掌握单质Cl2、S、P、Si和B与NaOH反应的方程 式

18.1.2非金属单质的化学反应 1、活泼的非金属(F2、Cl2、Br2、O2、P、S)与金属元素形成 卤化物、氧化物、硫化物、氢化物或含氧酸盐等; 2、非金属元素彼此之间也能形成卤化物、氧化物、无氧酸、含氧酸 等; 3、大部分非金属单质不与水反应,卤素仅部分地与水反应,碳在赤 热条件下才与水蒸气反应: 4、非金属一般不与非氧化性稀酸反应,硼、碳、磷、硫、碘、砷等 被浓HNO3、浓H2SO4及王水氧化,硅在含氧酸中被钝化,只 能在有氧化剂存在的条件下与氢氟酸反应。 5、除碳、氮、氧外,非金属单质可和碱溶液反应,对于有变价的非 金属元素主要发生歧化反应: CL,+2NaOH ==NaClO NaCI+H,O 31,+6NaOH ===5NaI+NalO +3H,O 4P+3NaOH+3H,O===3NaH,PO,+PH 硅、硼则从碱中置换出氢气: Si+2NaOH+H2O===Na2SiO3 2H21 3B+2NaOH+2H20===NaBO2+3H,1
18.1.2 非金属单质的化学反应 1、 活泼的非金属(F2 、Cl2 、Br2 、O2 、P、S)与金属元素形成 卤化物、氧化物、硫化物、氢化物或含氧酸盐等; 2、非金属元素彼此之间也能形成卤化物、氧化物、无氧酸、含氧酸 等; 3、大部分非金属单质不与水反应,卤素仅部分地与水反应,碳在赤 热条件下才与水蒸气反应; 4、非金属一般不与非氧化性稀酸反应,硼、碳、磷、硫、碘、砷等 被浓HNO3 、浓H2SO4 及王水氧化,硅在含氧酸中被钝化,只 能在有氧化剂存在的条件下与氢氟酸反应。 5、除碳、氮、氧外,非金属单质可和碱溶液反应,对于有变价的非 金属元素主要发生歧化反应: 硅、硼则从碱中置换出氢气: Cl2 + 2NaOH ===NaClO + NaCl + H2O 3I2 + 6NaOH ===5NaI + NaIO3 + 3H2O 4P + 3NaOH + 3H2O ===3NaH2PO2 + PH3 Si + 2NaOH + H2O===Na2SiO3 + 2H2 ↑ 3B + 2NaOH + 2H2O ===NaBO2 + 3H2 ↑
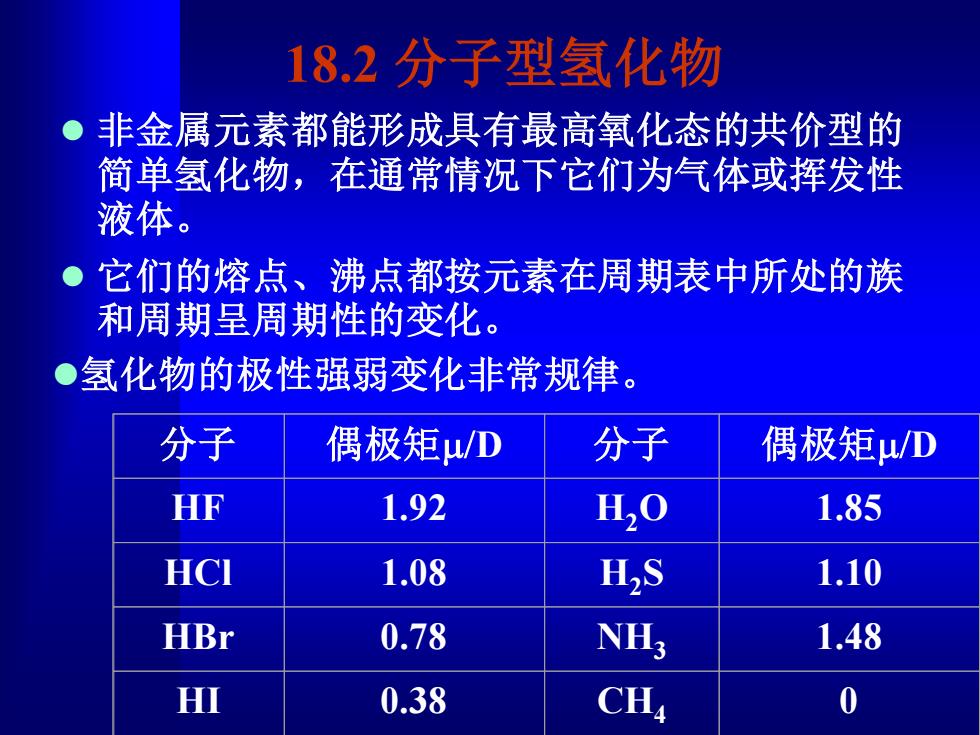
18.2分子型氢化物 非金属元素都能形成具有最高氧化态的共价型的 简单氢化物,在通常情况下它们为气体或挥发性 液体。 它们的熔点、沸点都按元素在周期表中所处的族 和周期呈周期性的变化。 ●氢化物的极性强弱变化非常规律。 分子 偶极矩μ/D 分子 偶极矩μ/D HF 1.92 H20 1.85 HCI 1.08 HS 1.10 HBr 0.78 NH; 1.48 HI 0.38 CH 0
18.2 分子型氢化物 ⚫ 非金属元素都能形成具有最高氧化态的共价型的 简单氢化物,在通常情况下它们为气体或挥发性 液体。 ⚫ 它们的熔点、沸点都按元素在周期表中所处的族 和周期呈周期性的变化。 分子 偶极矩m/D 分子 偶极矩m/D HF 1.92 H2O 1.85 HCl 1.08 H2S 1.10 HBr 0.78 NH3 1.48 HI 0.38 CH4 0 ⚫氢化物的极性强弱变化非常规律