
第6章 化学平衡常数 Chapter 6 Equilibrium constant
第6章 化学平衡常数 Chapter 6 Equilibrium constant

本章要求 1、建立化学平衡常数的概念。 2、掌握反应产率或反应物转化为产物的转化率的计算。 3、学会讨论浓度、分压、总压和温度对化学平衡的影响。 内容提要 ●化学平衡状态 。平衡常数 。浓度对化学平衡的影响 压力对化学平衡的影响 温度对化学平衡的影响 上页下页 节首节尾
2 本章要求 1、建立化学平衡常数的概念。 2、掌握反应产率或反应物转化为产物的转化率的计算。 3、学会讨论浓度、分压、总压和温度对化学平衡的影响。 ● 化学平衡状态 ● 平衡常数 ● 浓度对化学平衡的影响 ● 压力对化学平衡的影响 ● 温度对化学平衡的影响 内容提要
6.1化学平衡状态 (chemical equilibrium state 6.1.1化学平衡 6.1.2勒沙特列原理 Rate:for A.B Rate;=Rate? System at new equiibnum Rate Rate? Rate:for C D Rater=Rate? Rate:for C+D I-Tlow/ H H System at new Hz,l H2,l Rater for A.H Time Time b t/s t/s 上页 下页 节首节尾
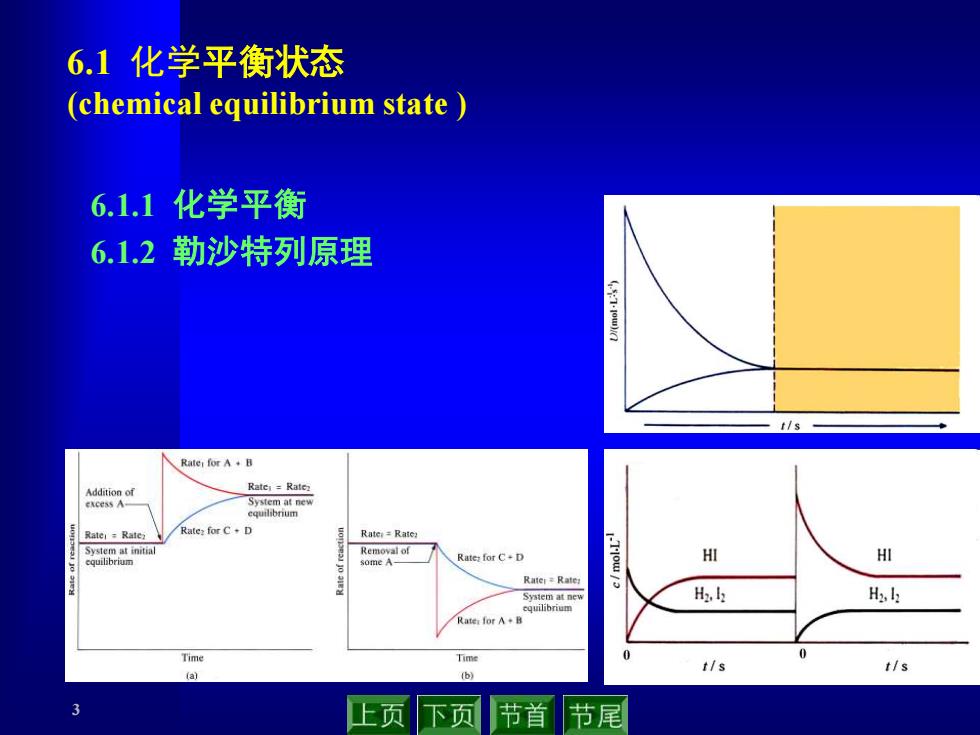
3 6.1 化学平衡状态 (chemical equilibrium state ) 6.1.1 化学平衡 6.1.2 勒沙特列原理

6.1.1化学平衡 平衡状态(equilibrium state) 什么是平衡状态? 就是△G=0或者u正=u负 化学反应有可逆反应与不可逆反应之分,但大多数化学反应都 是可逆的.例如: H2(g)+I2(g)=2HⅡ(g 在密闭容器中,可逆反应不能进行到底。个别反应几乎能进行 到底.例如: MnO, 2KC103(S) △ 2KCI(S)+302(g) 化学平衡有以下几个鲜明的特点 ●客观上,系统的组成不再随时间而变 平衡是自发的 化学平衡是动态平衡 平衡组成与达到平衡的途径无关 上页 下页 节首 节尾
4 就是 DG = 0 或者 u正 = u负 6.1.1 化学平衡 平衡状态 (equilibrium state) 什么是平衡状态? 在密闭容器中,可逆反应不能进行到底. 个别反应几乎能进行 到底. 例如: MnO2 H (g) I (g) 2HI(g) 2 + 2 化学反应有可逆反应与不可逆反应之分,但大多数化学反应都 是可逆的. 例如: 2KClO3 (s) 2KCl (s) +3O2 (g) ● 客观上,系统的组成不再随时间而变 ● 平衡是自发的 ● 化学平衡是动态平衡 ● 平衡组成与达到平衡的途径无关 化学平衡有以下几个鲜明的特点

旧的平衡破坏了,又会建立起新的平衡, Rate:for A B Addition of Rater =Rate2 excess A- System at new equilibrium Rater=Rate2 Rate2 for C+D Rater Rate2 System at initial Removal of equilibrium some A- Ratez for C+D Rater Rate2 System at new equilibrium Ratei for A+B Time Time (a) (b) 上页下页节首 节尾
5 旧的平衡破坏了,又会建立起新的平衡