
3.分析曝气的种类及各自特点。 4.氧总转移系数K,意义是什么? 附DO的测定(祺量法) 用碘量法测定水中溶解氧,水样常采集到溶解氧瓶中。采集水样时,要注意不使水样躁 气或有气泡残存于采样瓶中。可用水样冲洗溶解氧瓶后,沿瓶壁直接倾注水样或用虹吸法将 细管插入溶解氧瓶底部,注入水样至溢流出瓶容积的13一12左右。 水样采集后,为防止溶解氧的变化,应立即加固定剂于样品中,并存于冷暗处,同时记 录水温和大气压力。 一、方法原理 水样中加入硫酸锰和碱性碘化钾,水中溶解氧将低价锰氧化成高价锰,生成四价锰的氢 氧化物棕色沉淀。加酸后,氢氧化物沉淀溶解并与碘离子反应而释放出游离碘,以碘粉作指 示剂,用硫代硫酸钠滴定释放出碘,可计算溶解氧的含量。 二、仪器 1.250-300ml溶解氧瓶,见图1-3-5 狭缝 瓶寒 图1-3-5溶解氧瓶 三、试剂 1.硫酸锰溶液:称取480g硫酸锰(MnS04·4H,0或364gMmS0·H,0)溶于水,用 水稀释至1000ml。此溶液加到酸化过的碘化钾溶液中,遇淀粉不得产生蓝色。 2.碱性碘化钾溶液:称取500g氢氧化钠溶于300-400ml水中,另称取150g碘化钾(或 135g俱化钠)溶于200ml水中,待氢氧化钠溶液冷却后,将两溶液合并,混匀,用水稀释 至1000ml。如有沉淀,则放置过夜后,倾出上清液,贮于棕色瓶中。用橡皮塞塞紧,避光 保存。此溶液酸化后,遇淀粉应不呈蓝色。 3.1十5硫酸溶液

4.1%(mV)淀粉溶液:称取1g可溶性淀粉,用少量水调成糊状,再用刚煮沸的水冲 稀到100ml,冷却后,加入0.1g水杨酸或0.4g氯化锌防腐。 5.0.02500moL重铬酸钾标准溶液(1/6K,Cr,0,):称取置于105-110℃烘干2h并冷 却的重铬酸钾1.2258g,溶于水,移入1000ml容量瓶中,用水稀释到标线,摇匀。 6,硫代硫酸钠溶液:称取6.2g硫代疏酸钠(NaS,0,·5H20)溶于煮沸放冷的水中, 加入0,2g碳酸钠,用水稀释到1000ml。贮于棕色瓶中,使用前用0.02500mo1L重铬酸钾标 准溶液标定,标定方法如下: 于250ml狭量瓶中,加入100ml水和1g碘化钾,加入10.00ml0.02500mol/L重铬酸钾 标准溶液、5ml1十5硫酸溶液密塞,摇匀。于暗处静置5mn后,用待标定的硫代疏酸钠溶 液滴定到溶液呈淡黄色,加入1m1淀粉溶液,继续滴定至蓝色刚好褪去为止,记录用量。 M-1000x002500 形 式中:M一硫代硫酸钠溶液的浓度(molL) V一滴定时消耗硫代硫酸钠溶液的体积(m) 7、硫酸(p=1.84gml) 四、测定步骤 1.溶解氧的固定 用吸管插入溶解氧瓶的液面下,加入1ml硫酸锰溶液、2ml碱性碘化钾溶液、盖好瓶塞, 颠倒混合数次,静置。待棕色沉淀物降到瓶内一半时,再颠倒混合一次,待沉淀物下降至瓶 底。一般在取样现场固定。 2.析出碘 轻轻打开瓶塞,立即用吸管插入液面下加入2.0ml硫酸。小心盖好瓶塞,颠倒混合摇匀, 到沉淀物全部溶解为止,放置暗处5mim。 3.滴定 吸取100.0ml上述溶液于250ml锥形瓶中,用硫代硫酸钠溶液滴定到溶液呈淡黄色,加 入1m淀粉溶液,继续滴定到蓝色刚好褪去为止,记录硫代硫酸钠溶液用量 五、计算 溶解氧(0,mL)=M.x8×10 100 式中:M一硫代硫酸钠溶液的浓度(molL) V一滴定时消耗硫代硫酸钠溶液的体积(ml) 22

六、注意事项 L.如果水样中含有氧化性物质(如游离氯大于0.lmgL时),应预先于水样中加入硫代 硫酸钠去除。即用两个溶氧瓶各取一瓶水样,在其中一瓶加入5m1+5硫酸和1g碘化钾, 摇匀,此时游离出碘。以淀粉作指示剂,用硫代硫酸钠溶液滴定到蓝色刚褪,记下用量(相 当于去除游离氯的量)。于另一瓶水样中,加入同样量的硫代硫酸钠溶液,摇匀后,按操作 步骤测定。 2.如果水样呈强酸性或强碱性,可用氢氧化钠或硫酸溶液调到中性后测定。 实验四电解法处理含铬电镀废水 一、实验目的 1.通过实验进一步掌握电解法除铬原理: 2.了解电解法试验模型的主要组成和电解槽内部构造: 3.了解电压、电流、电解时间(水力停留时间)、pH值等因素对电解除铬效率的影响。 二、电解除铬基本原理 利用电解原理来处理废水中有害物质的方法称为电解法。电解过程中,阴极放出电子, 使废水中某些阳离子因得到电子被还原,阴极起还原剂的作用。阳极得到到电子,使废水中 某些阴离子因失去电子而被氧化,阳极起氧化剂的作用。废水进行电解反应时,废水中的有 毒物质在阳极和阴极分别进行氧化还原反应,结果产生新物质。这些新物质在电解过程中或 沉积于电极表面或沉淀于电解槽内,或生成气体从水中逸出,从而降低了废水中有害物质的 浓度。 电解法处理含铬废水的电解槽中,阳极一般为铁电极,在电解过程中铁板阳极溶解产 生亚铁离子。亚铁离子是强还原剂,在酸性条件下,可将废水中的六价铬还原为三价铬,其 离子反应方程如下: 阳极:Fe-2c→Fe Cr2O+6Fe2+14H*2Cr"+6Fe*+7H2O Cro+3Fe*+8H'3Fe+Cr+4H:0 在阴极除氢离子获得电子生成氢外,废水中的六价铬直接还原为三价铬。离子反应方 程式为: 23
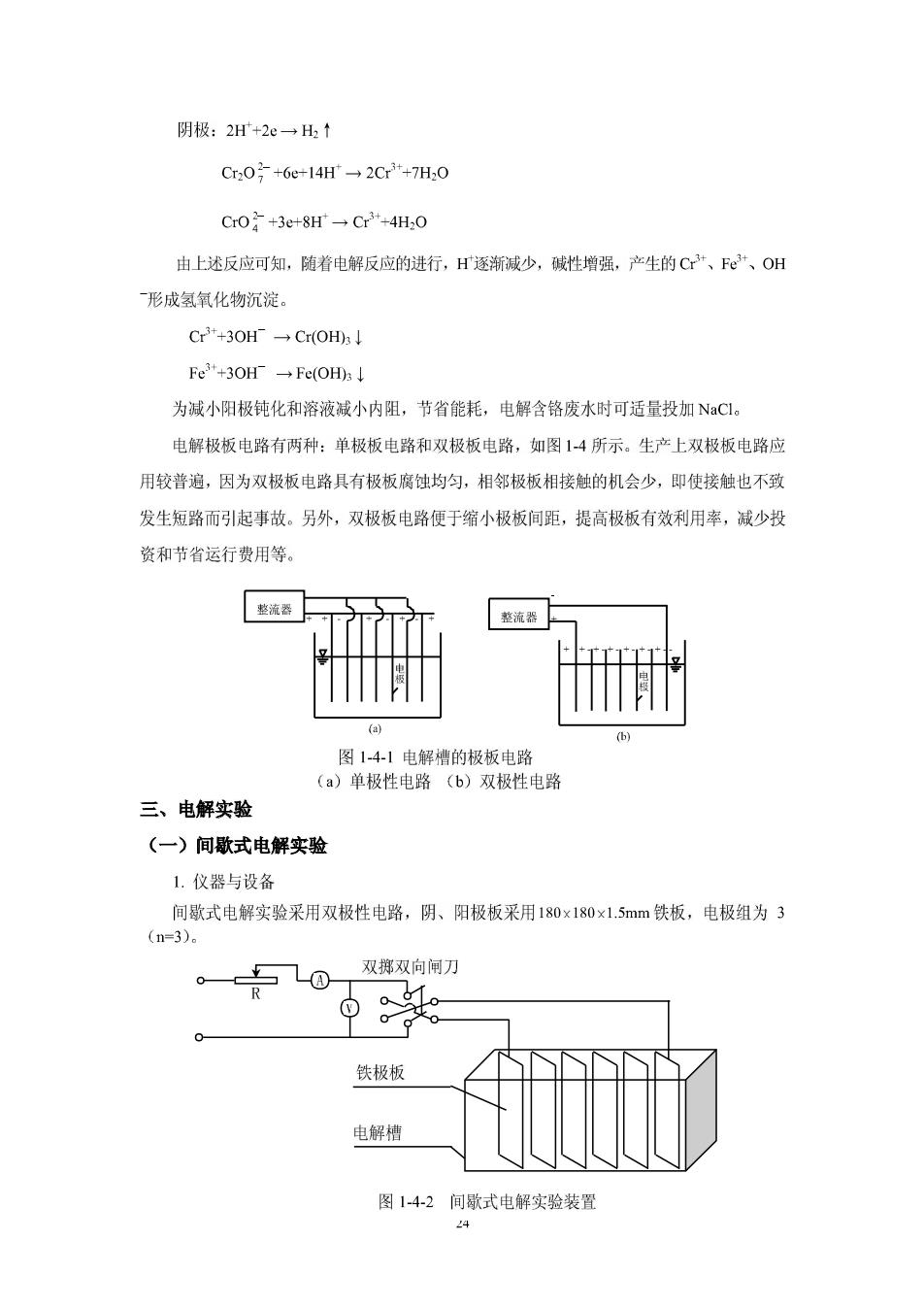
阴极:2H+2e→H2↑ Cr,0号+6e-14H→2C3t+7H,0 Cr0+3e-8H一Cr+4H,0 由上述反应可知,随着电解反应的进行,H逐渐减少,碱性增强,产生的C、Fe、OH 形成氢氧化物沉淀。 Cr+30H→Cr(OHl Fe+3OH→Fc(OHl 为减小阳极钝化和溶液减小内阻,节省能耗,电解含铬废水时可适量投加NaC1。 电解极板电路有两种:单极板电路和双极板电路,如图14所示。生产上双极板电路应 用较普遍,因为双极板电路具有极板腐蚀均匀,相邻极板相接触的机会少,即使接触也不致 发生短路而引起事故。另外,双极板电路便于缩小极板间距,提高极板有效利用率,减少投 资和节省运行费用等。 整流器 图14-1电解槽的极板电路 (a)单极性电路 (b)双极性电路 三、电解实验 (一)间歇式电解实验 1.仪器与设备 间歇式电解实验采用双极性电路,阴、阳极板采用180x180x1.5mm铁板,电极组为3 (n=3)。 双掷双向屑) 0 铁极板 电解檣 图142间歇式电解实验装置
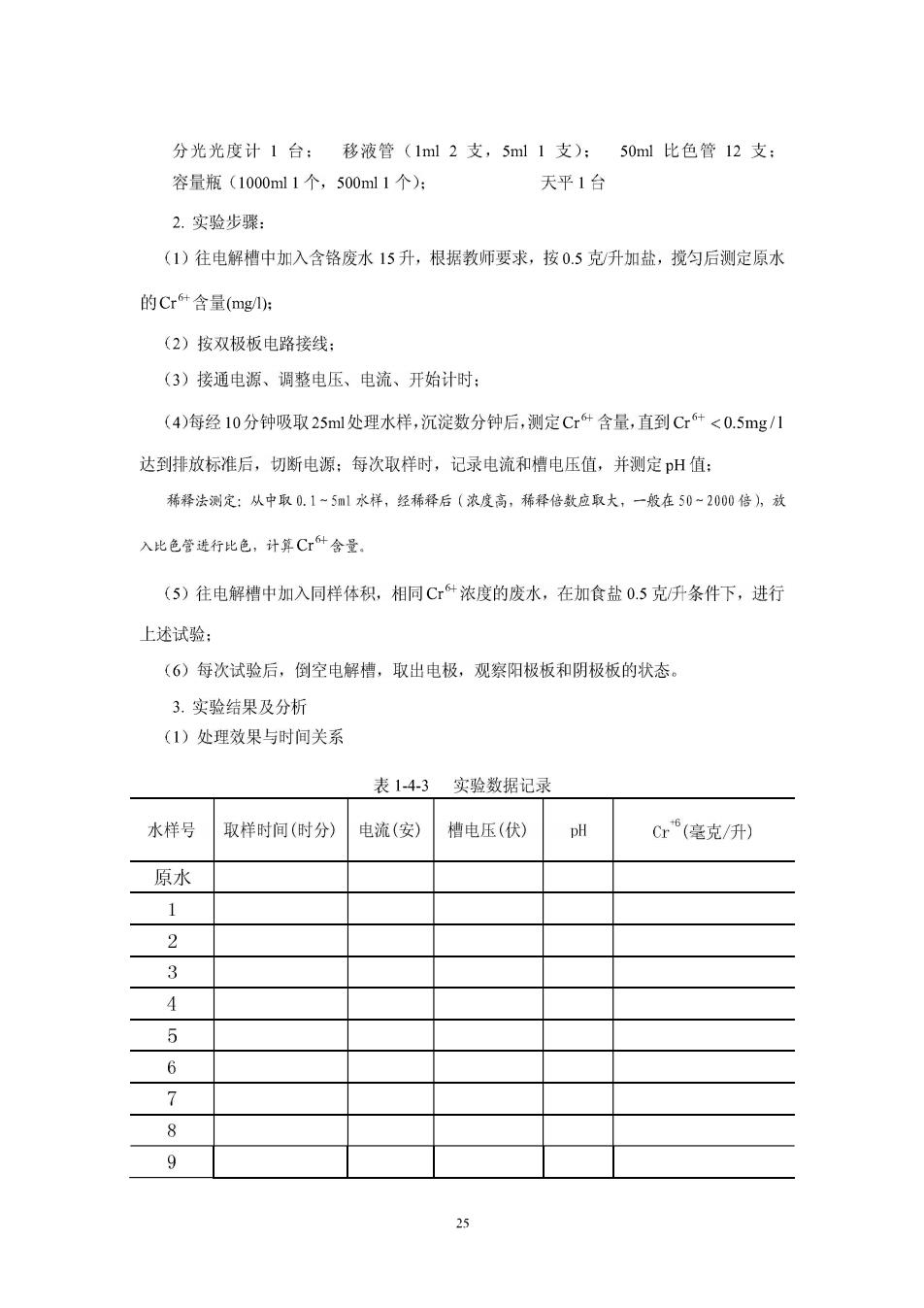
分光光度计1台: 移液管(1ml2支,5ml1支): 50ml比色管12支 容量瓶(1000ml1个,500ml1个): 天平1台 2.实验步骤: (1)往电解槽中加入含铬废水15升,根据教师要求,按0.5克升加盐,搅匀后测定原水 的Cr+含量(mg): (2)按双极板电路接线: (3)接通电源、调整电压、电流、开始计时: (4)每经10分钟吸取25ml处理水样,沉淀数分钟后,测定Cr+含量,直到Cr+<0.5mg1 达到排放标准后,切断电源:每次取样时,记录电流和槽电压值,并测定pH值: 稀择法测定:从中取0.1~5ml水样,经稀释后(浓度高,稀释倍数应取大,一般在50~200倍,效 入比色管进行比色,计算C什舍量. (5)往电解槽中加入同样体积,相同C+浓度的废水,在加食盐0.5克升条件下,进行 上述试验: (6)每次试验后,倒空电解槽,取出电极,观察阳极板和阴极板的状态。 3.实验结果及分析 (1)处理效果与时间关系 表1-4-3 实验数据记录 水样号 取样时间(时分) 电流(安) 槽电压(伏) Cr(毫克/开) 原水 1 3 5 6 7 8 9