
乙炔分子中两个碳原子的sp轨道,有hs性质,s轨 道中的电子离核较近,因此被约束得较牢,sp轨道比sp? 轨道要小,因此s杂化的碳所形成的键比sp杂化的碳要 短,它的p电子云有较多的重叠。 键长、键能比较 C-C C三C C=C 键长 154 134 120 pm 键能 347.3 610.9 836.8 kJ/mol C=C键第一个π键能225.9kmo1(836.8-610.9=225.9) C=C键π键能263.6kJmo1(610.9-347.3=263.6)
6 乙炔分子中两个碳原子的sp轨道,有½ s性质,s轨 道中的电子离核较近,因此被约束得较牢,sp轨道比sp2 轨道要小,因此sp杂化的碳所形成的键比sp2杂化的碳要 短,它的p电子云有较多的重叠。 C≡C键 第一个π键能225.9 kJ·mol-1 ( 836.8-610.9=225.9) C=C 键 π键能263.6 kJ·mol-1 ( 610.9-347.3=263.6)
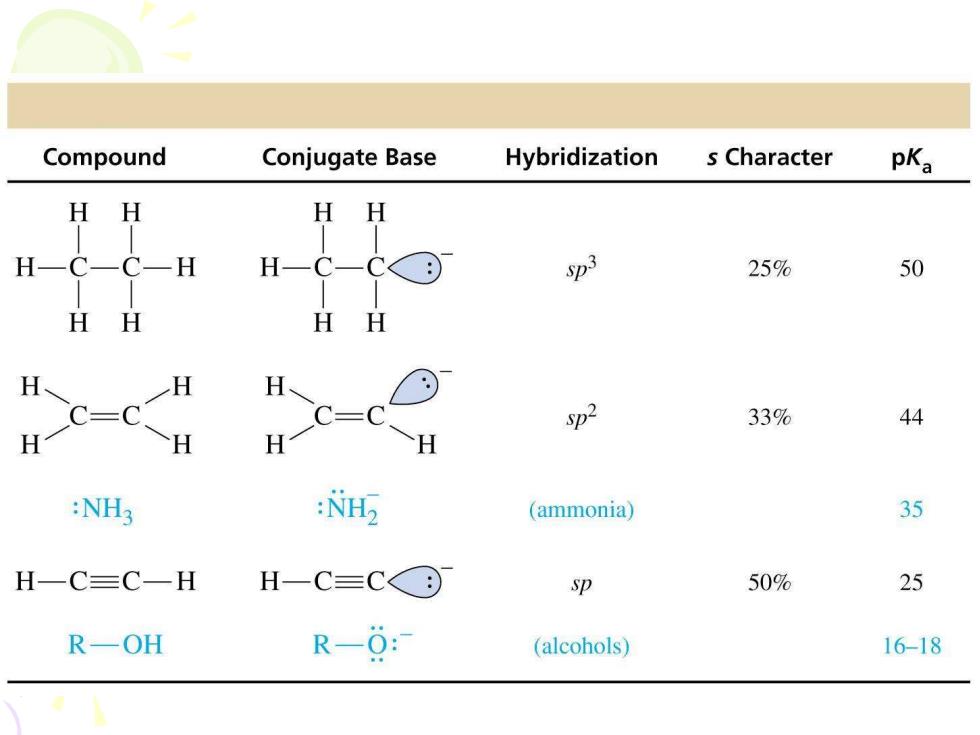
Compound Conjugate Base Hybridization s Character pKa HH HH HC一C一H H-C-C 3 25% 50 HH H H H H p 33% 44 H H :NH3 :NH2 (ammonia) 35 H一C≡C一H H一C=C⊙ sp 50% 25 R—OH R-0: (alcohols) 16-18
7
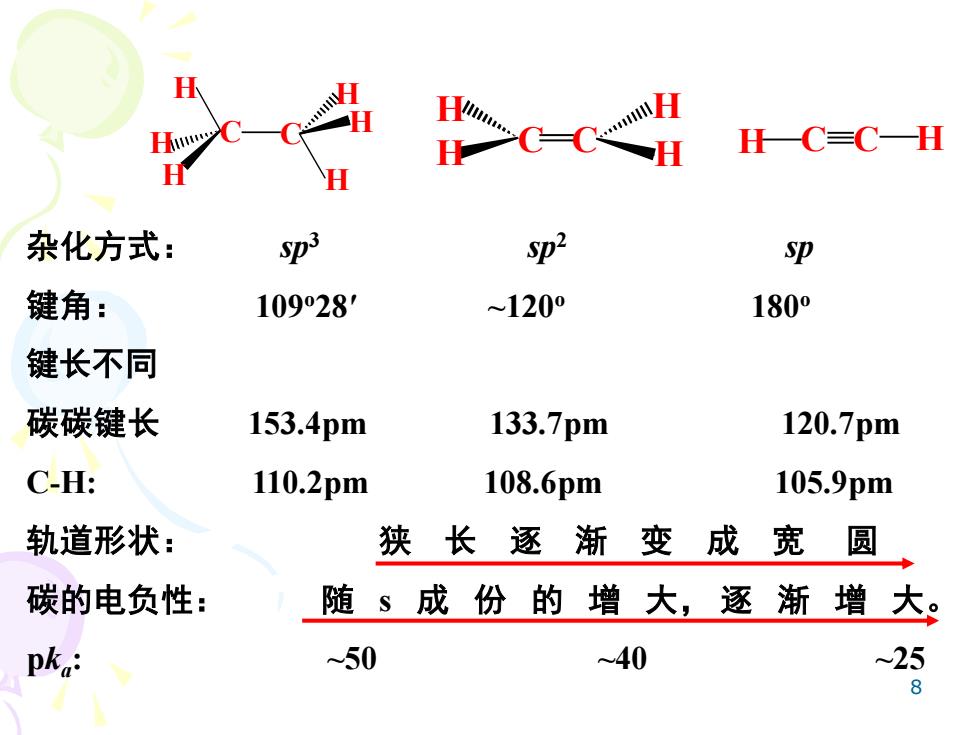
BC-CH HC=C-H 杂化方式: Sp3 Sp2 Sp 键角: 10928' ~1200 1800 键长不同 碳碳键长 153.4pm 133.7pm 120.7pm C-: 110.2pm 108.6pm 105.9pm 轨道形状: 狭长逐渐变成宽圆 碳的电负性: 随§成份的增大,逐渐增大。 pka ~50 ~40 25 8
8 杂化方式: sp3 sp2 sp 键角: 109o28′ ~120o 180o 键长不同 碳碳键长 153.4pm 133.7pm 120.7pm C-H: 110.2pm 108.6pm 105.9pm 轨道形状: 狭 长 逐 渐 变 成 宽 圆 碳的电负性: 随 s 成 份 的 增 大, 逐 渐 增 大。 pka : ~50 ~40 ~25 C C H H H H H H H H H H C C H C C H

异构和命名 。由于CC=C-C在一条直线上,因而炔烃没有 顺反异构体,炔烃的构造异构是由碳链不同 或叁键位置不同而引起的。 9
9 二、异构和命名 • 由于C-C≡C-C在一条直线上,因而炔烃没有 顺反异构体,炔烃的构造异构是由碳链不同 或叁键位置不同而引起的

命名 一般用系统法命名。命名原则与烯烃类似。 当分子中既有叁键又有双键时称为烯炔,命名 时,选含有叁键和双键的最长碳链作为主链, 给双键和叁键以尽可能小的编号(位次总和最 小);若位号有选择时,给双键以小的位号; 命名时烯在前炔在后,写成“某烯某炔” 10
10 命名 一般用系统法命名。命名原则与烯烃类似。 当分子中既有叁键又有双键时称为烯炔,命名 时,选含有叁键和双键的最长碳链作为主链, 给双键和叁键以尽可能小的编号(位次总和最 小);若位号有选择时,给双键以小的位号; 命名时烯在前炔在后,写成“某烯某炔