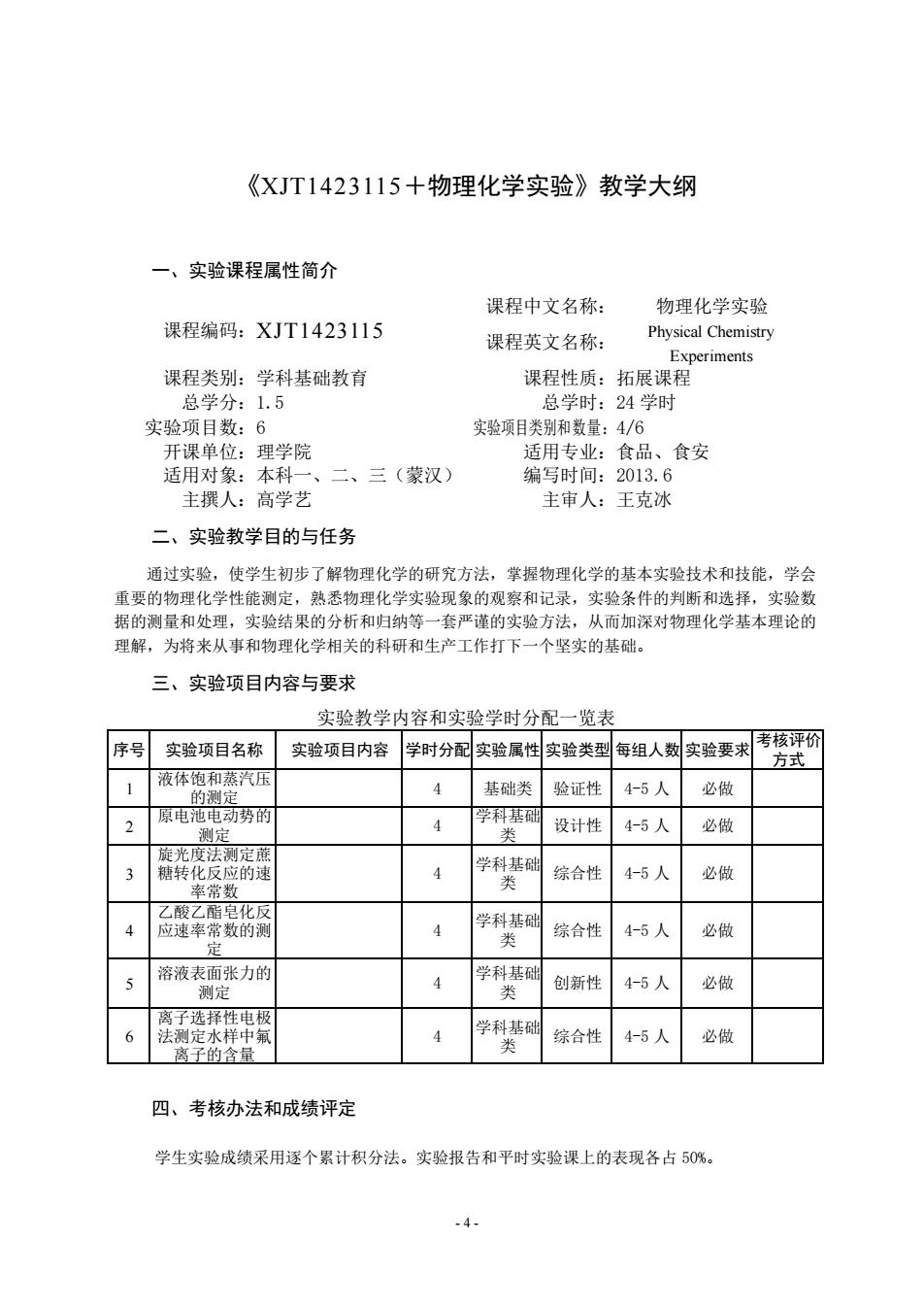
《XJT1423115+物理化学实验》教学大纲 一、实验课程属性简介 课程中文名称 物理化学实验 课程编码:XJT1423115 课程英文名称: Physical Chemistry Experiments 课程类别:学科基础教育 课程性质:拓展课程 总学分:1.5 总学时:24学时 实验项目数:6 实验项目类别和数量:4/6 适用专业:食品、食安 二、三(蒙汉) 编写时间:2013.6 主撰人:高学艺 主审人:王克冰 二、实验教学目的与任务 通过实验,使学生初步了解物理化学的研究方法, 掌握物理化学的基本实验技术和技能,学会 重要的物理化学性能测定,熟悉物理化学实验现象的观察和记录,实验条件的判断和选择,实验数 据的测量和处理,实验结果的分析和归纳等一套严谨的实验方法,从而加深对物理化学基本理论的 理解,为将来从事和物理化学相关的科研和生产工作打下一个坚实的基础。 三、实验项目内容与要求 实验教学内容和实验学时分配一览表 序号实验项目名称 实项目内容学时分实验属性实验类型每组人实验要术列 1 液体饱和蒸汽压 4 基础类验证性4-5人 必做 原电电动势 2 4 设计性4-5人 必做 光度法测定 4 学科基础 综合性 4-5人 必做 乙酸乙酯皂化反 应速率常数的 学科基酬综合性 4-5 必做 溶液表面张力的 4 学科基础 创新性 4-5人 必做 4 学科基础 综合性 4-5人 必做 离子的含量 四、考核办法和成绩评定 学生实验成绩采用遂个累计积分法。实验报告和平时实验课上的表现各占50% .4
- 4 - 《XJT1423115+物理化学实验》教学大纲 一、实验课程属性简介 课程编码:XJT1423115 课程中文名称: 物理化学实验 课程英文名称: Physical Chemistry Experiments 课程类别:学科基础教育 课程性质:拓展课程 总学分:1.5 总学时:24 学时 实验项目数:6 实验项目类别和数量:4/6 开课单位:理学院 适用专业:食品、食安 适用对象:本科一、二、三(蒙汉) 编写时间:2013.6 主撰人:高学艺 主审人:王克冰 二、实验教学目的与任务 通过实验,使学生初步了解物理化学的研究方法,掌握物理化学的基本实验技术和技能,学会 重要的物理化学性能测定,熟悉物理化学实验现象的观察和记录,实验条件的判断和选择,实验数 据的测量和处理,实验结果的分析和归纳等一套严谨的实验方法,从而加深对物理化学基本理论的 理解,为将来从事和物理化学相关的科研和生产工作打下一个坚实的基础。 三、实验项目内容与要求 实验教学内容和实验学时分配一览表 序号 实验项目名称 实验项目内容 学时分配 实验属性 实验类型 每组人数 实验要求 考核评价 方式 1 液体饱和蒸汽压 的测定 4 基础类 验证性 4-5 人 必做 2 原电池电动势的 测定 4 学科基础 类 设计性 4-5 人 必做 3 旋光度法测定蔗 糖转化反应的速 率常数 4 学科基础 类 综合性 4-5 人 必做 4 乙酸乙酯皂化反 应速率常数的测 定 4 学科基础 类 综合性 4-5 人 必做 5 溶液表面张力的 测定 4 学科基础 类 创新性 4-5 人 必做 6 离子选择性电极 法测定水样中氟 离子的含量 4 学科基础 类 综合性 4-5 人 必做 四、考核办法和成绩评定 学生实验成绩采用逐个累计积分法。实验报告和平时实验课上的表现各占 50%

五、推荐实验指导书 (一)推荐教材 参考书日 六、实验课程说明 实验项目(一)液体饱和蒸汽压的测定(4学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1、掌握静态法测定液体不同温度下饱和蒸气压的方法: 2、明确液体饱和蒸气压的定义及气一液平衡的概念,了解纯液体饱和蒸气压与温度的关系:克 劳修斯一克拉贝龙方式 3、计算乙醇在实验温度范用内的平均摩尔气化热 实验项目内容: 乙醇液体饱和蒸气压的测定 实验方法与步骤: 、将实哈装罗连结组装 2、检查气密性 先关闭进气阀和平衡阀1,平衡阀2不动,然后接通真空泵电源,打开进气阀抽气,此时压力计 的显示压力随系统减压程度的加大而增加。当压力计显示压力为-8Ok即a时,关闭进气阀,再断开真 空泵电源开关,如果在五分钟内,压力计显示压力基本不变。则表明系统不漏气:若有变化,则说 明漏气,应仔细检查各接口处直至不漏气为止。 3、不同温度下乙醇的饱和蒸气压的测定 加热水浴至25℃或30℃(高于室温5℃即可)。开动真空泵,接通冷凝水,开启进气阀缓缓抽 气。使试液球与U型等位计之间的空气呈气泡状通过U型等位计的液体而逐出。如发现气泡成串上 帘(此时液体已沸腾)缓缓打开阀1,漏入空气,使沸腾缓和。如此沸腾了3一4分钟试液球中的空 气排除后,小心调节阀1直至U型等位计中双臂的液面等高为止,在压力计上读出并记下压力值。 重复操作一次,压力计上的读数与前一次相差应不大于±67Pa,此时可认为试液球与U型等位计上 的空间全部为乙醇的蒸气所充满, 如法测定30℃、35℃、40℃、45℃、50C时乙醇的蒸汽压。 实验结束后,慢慢打开进气活塞,使压力计恢复零位,关闭冷凝水,将抽气活塞旋至与大气相 通,拔去电源插头 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材: 1.仪器:液体饱和蒸汽压测定装置,精密数字压力计,不锈钢缓冲储出气罐,真空泵,玻璃恒 温槽水浴,等压计连冷凝管,冷阱 2.试剂:无水乙醇(A.R) -5
- 5 - 五、推荐实验指导书 (一)推荐教材 1.张秀芳等主编、《物理化学实验》、中国农业大学出版社、2011 年 2.周建敏,蔡洁主编、《物理化学实验》、中国石化出版社、2012 年 (二)参考书目 1.刘廷岳,王岩、《物理化学实验》、中国纺织出版社、2006 2.罗澄源,向明礼、《物理化学实验》、高等教育出版社、2004 六、实验课程说明 实验项目(一) 液体饱和蒸汽压的测定(4 学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1、掌握静态法测定液体不同温度下饱和蒸气压的方法; 2、明确液体饱和蒸气压的定义及气—液平衡的概念,了解纯液体饱和蒸气压与温度的关系:克 劳修斯—克拉贝龙方式; 3、计算乙醇在实验温度范围内的平均摩尔气化热。 实验项目内容: 乙醇液体饱和蒸气压的测定 实验方法与步骤: 1、将实验装置连结组装。 2、检查气密性: 先关闭进气阀和平衡阀1,平衡阀2不动,然后接通真空泵电源,打开进气阀抽气,此时压力计 的显示压力随系统减压程度的加大而增加。当压力计显示压力为-80kpa时,关闭进气阀,再断开真 空泵电源开关,如果在五分钟内,压力计显示压力基本不变。则表明系统不漏气;若有变化,则说 明漏气,应仔细检查各接口处直至不漏气为止。 3、不同温度下乙醇的饱和蒸气压的测定 加热水浴至 25℃或 30℃(高于室温 5℃即可)。开动真空泵,接通冷凝水,开启进气阀缓缓抽 气。使试液球与 U 型等位计之间的空气呈气泡状通过 U 型等位计的液体而逐出。如发现气泡成串上 窜(此时液体已沸腾)缓缓打开阀 1,漏入空气,使沸腾缓和。如此沸腾了 3~4 分钟试液球中的空 气排除后,小心调节阀 1 直至 U 型等位计中双臂的液面等高为止,在压力计上读出并记下压力值。 重复操作一次,压力计上的读数与前一次相差应不大于±67Pa,此时可认为试液球与 U 型等位计上 的空间全部为乙醇的蒸气所充满。 如法测定 30℃、35℃、40℃、45℃、50℃时乙醇的蒸汽压。 实验结束后,慢慢打开进气活塞,使压力计恢复零位,关闭冷凝水,将抽气活塞旋至与大气相 通,拔去电源插头 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材: 1.仪器:液体饱和蒸汽压测定装置,精密数字压力计,不锈钢缓冲储出气罐,真空泵,玻璃恒 温槽水浴,等压计连冷凝管,冷阱 2.试剂:无水乙醇(A.R)

实验项目(二)原电池电动势的测定(4学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1、了解对消法测电动势的基本原理、仪器构造和使用方法: 2、测定原电池的电动势及电极电势: 原电池电动势的测定 实验方法与步骤: 1、制备盐桥: 将约25ml蒸馏水 玻璃棒搅拌 等檬脂克0及0304克玻酯(的半牛角勺)放入烧杯中加热并不新用一 冷却后凝成胶冻即可使用。 2、电极的制备: (1)饱和甘汞电极(由实验室制备),使用时注意如有气泡应排除,甘汞电极使用后勿倒掉! (2)氢醒电极:将待测HC溶液倒入一支半电池管内,加入少量氢醒使其过饱和,插入一支洗净 擦干的铂申极。 (3)银电极:用砂纸将Ag电极的表面擦亮,再用少量Q.02 mol-L AgNO,溶液冲洗,插入盛有 0.02molLAgNO溶液的半电池管内 (4)氯化银电极:用少量0.02 mol-L KC1溶液冲洗己镀好AgC的Ag一AgCI电极,然后插入盛 有0.02 mol-L-KC1溶液的半电池管中。 3、打开数字申位差计电源预热15一20分钟。 4、调标准:(视仪器洗择下列一种调标准的方法) 外标:将电极引线按 负极插入外标位置,接通标准电池,选择旋钮打到外标位置,将标准 电动势给定,按校淮按钮使平衡指示为零。 内标:将选择旋钮打到内标位置,给定1V电动势,按校准按钮使平衡指示为零。 5、测电池电动势:将电极引线按正、负极插入测量位置,接通原电池,选择旋钮打到“测量”位 置,调档使平衡指示为零,读数。 6、更换电极重复以上操作测量另两个电池的电动势 7、实验完毕拆除线路和仪器电源,将饱和甘汞电极放回饱和K©!溶液中保存,其它试剂倒入废 液桶中,清洗电极和烧杯,整理仪器及桌面。 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材: 1、仪器: 数字式电子电位差计1台,Ag、Pt、氯化银电极各一支、饱和甘汞电极1支、标准电池一块, 烧杯50ml四个 2、试剂: KC饱和溶液,KC0.02molL,HCI0.1molL,醌、氢醌,AgNO30.200molL 实验项目(三)旋光度法测定蔗糖转化反应的速率常数(4学时) 实验项目类型:缤合性 .6-
- 6 - 实验项目(二) 原电池电动势的测定(4 学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1、了解对消法测电动势的基本原理、仪器构造和使用方法; 2、测定原电池的电动势及电极电势: 3、测定难溶电解质的溶度积常数。 实验项目内容: 原电池电动势的测定 实验方法与步骤: 1、制备盐桥: 将约 25 ml 蒸馏水、2 克 NH4NO3 及 0.3~0.4 克琼脂(约半牛角勺)放入烧杯中加热,并不断用 玻璃棒搅拌,待琼脂溶解后停止加热,冷却后凝成胶冻即可使用。 2、电极的制备: (1)饱和甘汞电极(由实验室制备),使用时注意如有气泡应排除,甘汞电极使用后勿倒掉! (2)氢醌电极:将待测 HCl 溶液倒入一支半电池管内,加入少量氢醌使其过饱和,插入一支洗净 擦干的铂电极。 (3)银电极:用砂纸将 Ag 电极的表面擦亮,再用少量 0.02 mol•L-1 AgNO3 溶液冲洗,插入盛有 0.02 mol•L-1 AgNO3 溶液的半电池管内。 (4)氯化银电极:用少量 0.02 mol•L-1 KCl 溶液冲洗已镀好 AgCl 的 Ag-AgCl 电极,然后插入盛 有 0.02 mol•L-1 KCl 溶液的半电池管中。 3、打开数字电位差计电源预热 15—20 分钟。 4、调标准:(视仪器选择下列一种调标准的方法) 外标:将电极引线按正、负极插入外标位置,接通标准电池,选择旋钮打到外标位置,将标准 电动势给定,按校准按钮使平衡指示为零。 内标:将选择旋钮打到内标位置,给定 1V 电动势,按校准按钮使平衡指示为零。 5、测电池电动势:将电极引线按正、负极插入测量位置,接通原电池,选择旋钮打到“测量”位 置,调档使平衡指示为零,读数。 6、更换电极重复以上操作测量另两个电池的电动势。 7、实验完毕拆除线路和仪器电源,将饱和甘汞电极放回饱和 KCl 溶液中保存,其它试剂倒入废 液桶中,清洗电极和烧杯, 整理仪器及桌面。 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材: 1、仪器: 数字式电子电位差计 1 台,Ag、Pt、氯化银电极各一支、饱和甘汞电极 1 支、标准电池一块, 烧杯 50 ml 四个 2、试剂: KCl 饱和溶液,KCl 0.02 mol•L-1,HCl 0.1 mol•L-1 , 醌、氢醌,AgNO3 0.200 mol•L-1 实验项目(三) 旋光度法测定蔗糖转化反应的速率常数(4 学时) 实验项目类型:综合性

实验项目性质:拓展 实验项目目的 、根据物质的光学性质研究蔗糖水解反应,测定其反应速度常数 2、了解旋光仪的基本原理、掌握使用方法。 实验项目内容: 原电池电动势的测定 实验方法与步骤: 将恒温 节到25C恒温,在锥形瓶内,称取10克蔗糖,加入100mL蒸馏水,使其完全 溶解,若溶液混浊 则需要过滤。用移液管移取25ml蔗糖溶液溶于锥形瓶中,然后放入恒温水浴 中10分钟。另同样取25ml盐酸溶液放入恒温槽中。 2、校正旋光度仪零点。 打开旋光度仪器预热几分钟,旋光管内注满蒸馏水,痺紧套盖,用纸擦净两端玻璃片,放入湖 光仪内 盖上盖。 3、蔗糖水解过程中a,的测定 从恒温槽中取出蔗糖溶液,将25ml2molL'HC1溶液加入蔗糖溶液使其混合均匀。取加入一半 C1时作为反应开始时间,迅速取少量混合液清洗旋光管两三次。然后注满旋光管,测量各时间t 时溶液的旋光度。分别测得时间为5、10、 15、20、25、30、40、50、60分钟 时的旋光度。 4、a的测定 将反应剩余的混合液置5060℃的热水浴中,温热30分钟,以加速转化反应的进行,然后冷 却,再恒温至25℃,测旋光度,此值即为反应终了时的旋光度。 5、实验结束时,立刻将旋光管洗净干燥,以免酸对旋光管的腐蚀 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材 旋米议 移液管(25ml.50ml) 恒温 葡萄糖(分析纯) 容量瓶 蔗糖(分析纯》 HC1溶液(2mol/L) 实验项目(四)乙酸乙酯皂化反应速率常数的测定(4学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1.了解测定化学反应速率常数的一种物理方法一电导法。 2.了解二级反应的特点,学会用图解法求二级反应的速率常数,并计算反应的活化能。 3.掌握电导率仪的使用方法 实验项目内容: 乙酸乙酯皂化反应速率常数的测定 实验方法与步骤: 1.恒温槽谓节调节恒温槽温度为298.2K(25土0.2℃)。 .7
- 7 - 实验项目性质:拓展 实验项目目的: 1、根据物质的光学性质研究蔗糖水解反应,测定其反应速度常数。 2、了解旋光仪的基本原理、掌握使用方法。 实验项目内容: 原电池电动势的测定 实验方法与步骤: 1、将恒温槽调节到 25C 恒温,在锥形瓶内,称取 10 克蔗糖,加入 100mL 蒸馏水,使其完全 溶解,若溶液混浊,则需要过滤。用移液管移取 25ml 蔗糖溶液溶于锥形瓶中,然后放入恒温水浴 中 10 分钟。另同样取 25ml 盐酸溶液放入恒温槽中。 2、校正旋光度仪零点。 打开旋光度仪器预热几分钟,旋光管内注满蒸馏水,旋紧套盖,用纸擦净两端玻璃片,放入旋 光仪内,盖上槽盖。调节目镜使视野清晰。然后旋转检偏镜能观察到明暗相等的三分视野为止,记 下刻度盘读数,重复操作三次,取其平均值,此即为旋光仪零点。测毕取出旋光管,倒出蒸馏水。 3、蔗糖水解过程中 t 的测定 从恒温槽中取出蔗糖溶液,将 25ml 2mol.L -1 HCl 溶液加入蔗糖溶液使其混合均匀。取加入一半 HCl 时作为反应开始时间,迅速取少量混合液清洗旋光管两三次。然后注满旋光管,测量各时间 t 时溶液的旋光度。分别测得时间为 5、10、15、20、25、30、40、50、60 分钟 时的旋光度。 4、 的测定 将反应剩余的混合液置 50~60 C 的热水浴中,温热 30 分钟,以加速转化反应的进行,然后冷 却,再恒温至 25C,测旋光度,此值即为反应终了时的旋光度。 5、实验结束时,立刻将旋光管洗净干燥,以免酸对旋光管的腐蚀。 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材 旋光仪 移液管(25ml,50ml) 恒温槽 葡萄糖(分析纯) 容量瓶 蔗糖(分析纯) HCl 溶液(2mol/L) 实验项目(四) 乙酸乙酯皂化反应速率常数的测定(4 学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1.了解测定化学反应速率常数的一种物理方法-电导法。 2.了解二级反应的特点,学会用图解法求二级反应的速率常数,并计算反应的活化能。 3.掌握电导率仪的使用方法。 实验项目内容: 乙酸乙酯皂化反应速率常数的测定 实验方法与步骤: 1.恒温槽调节 调节恒温槽温度为 298.2K(25±0.2℃)

2.预热电导率仪并进行调节 3.G和G的测定 用移液管准确移取0.0100 molLNa0溶液100ml于电导瓶中,盖好、夹紧,置于恒温槽中恒温 20min。用电导率仪测定已恒温好的NaOH溶液的电导率G。 用移液管准确移取0.0100 molL CHC0ONa溶液100mL于电导瓶中,盖好、夹紧,置于恒温槽中恒 温20■in。用电导率仪测定已恒温好的CHC0Oa溶液的电导率G。 4.G,的测定 用微量注射器准确吸取98μL乙酸乙酯迅速注入盛有100mL0.0100 molL Nac0H溶液的电导瓶 中,马上塞紧塞子,同时立即开动停表记录时间。然后小心摇匀,每隔5分钟测定一次G,反应进 行40分钟后停止测定。 5.调节恒温梧温度为303.2K(30℃),重复上述步骤测定其G。、G和G,值。 实验要求】 顺利完成实验操作,正确处理实验数据并按时完成实验报告 实验场地、主要设备与器材 仪器:DDS-11A型电导率仪(附铂黑电极)1台,恒温水槽1套,停表1只,150mL的锥形瓶3 个(带橡皮塞)做电导瓶,50ml移液管一支,微量注射器(100μL)一支。 药品:乙酸乙酯(分析纯),0.0100 molL Na0H,0.0100 molLCH,000Na溶液 实验项目(五)溶液表面张力的测定(4学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的 1.测定不同浓度的正丁醇水溶液的表面张力。 2。掌握一种测定液体表面张力的方法-最大起泡法。 3.了解表面活性物质降低液体表面张力的作用,从而加深对吉布斯等温吸附方程式的理解。 实验项目内容: 溶液表面张力的测完 实验方法与步骤: 1、分别配制浓度为0.010、0.020、0.050、0.10、0.15、0.20、0.25、0.30、0.35o1.L的正 丁醇溶液100ml。配制方法如下:洗净、烘干10c比重瓶一只,于其中注满正丁醇,迅速称量,设 称量所得质量为m,求其比重P。根据公式:溶液的原摩尔浓度为G=p/74.12mol·,用刻 度移液管量取体积g。2×100×7412u的正丁醇(其中a为所需配制的溶液浓度),注入100L容量 瓶中,以水稀释至刻度,即得2。 用同法配制其它浓度的溶液」 -8-
- 8 - 2.预热电导率仪并进行调节 3. G0 和 G 的测定 用移液管准确移取 0.0100mol•L-1 NaOH 溶液 100mL 于电导瓶中,盖好、夹紧,置于恒温槽中恒温 20 min。用电导率仪测定已恒温好的 NaOH 溶液的电导率 G0 。 用移液管准确移取 0.0100mol•L -1 CH3COONa 溶液 100mL 于电导瓶中,盖好、夹紧,置于恒温槽中恒 温 20 min。用电导率仪测定已恒温好的 CH3COONa 溶液的电导率 G 。 4. Gt 的测定 用微量注射器准确吸取 98μL 乙酸乙酯迅速注入盛有 100mL 0.0100mol•L-1 NaOH 溶液的电导瓶 中,马上塞紧塞子,同时立即开动停表记录时间 t。然后小心摇匀,每隔 5 分钟测定一次 Gt ,反应进 行 40 分钟后停止测定。 5.调节恒温槽温度为 303.2K(30℃),重复上述步骤测定其 G0 、G 和 Gt 值。 实验要求: 顺利完成实验操作,正确处理实验数据并按时完成实验报告。 实验场地、主要设备与器材 仪器:DDS-11A 型电导率仪(附铂黑电极)1 台,恒温水槽 1 套,停表 1 只,150mL 的锥形瓶 3 个(带橡皮塞)做电导瓶,50mL 移液管一支,微量注射器(100μL)一支。 药品:乙酸乙酯(分析纯),0.0100mol•L-1 NaOH,0.0100mol•L-1 CH3COONa 溶液 实验项目(五) 溶液表面张力的测定(4 学时) 实验项目类型:综合性 实验项目性质:拓展 实验项目目的: 1.测定不同浓度的正丁醇水溶液的表面张力。 2.掌握一种测定液体表面张力的方法-最大起泡法。 3.了解表面活性物质降低液体表面张力的作用,从而加深对吉布斯等温吸附方程式的理解。 实验项目内容: 溶液表面张力的测定 实验方法与步骤: 1、分别配制浓度为 0.010、0.020、0.050、0.10、0.15、0.20、0.25、0.30、0.35mol.L-1 的正 丁醇溶液 100mL。配制方法如下:洗净、烘干 10cm3 比重瓶一只,于其中注满正丁醇,迅速称量,设 称量所得质量为 m,求其比重ρ。根据公式:溶液的原摩尔浓度为 -1 1 c = 74.12mol mL ,用刻 度移液管量取体积 2 1 100 74.12 mL c V = 的正丁醇(其中 c2 为所需配制的溶液浓度),注入 100mL 容量 瓶中,以水稀释至刻度,即得 c2。 用同法配制其它浓度的溶液