
①定义:发生在两相平衡共存的T,P下的相变 可逆相变 例:H0() IP→H0(g) T=373K,P*=P=101325Pa T=298K,P*=3168Pa T体=T环,P体=P环=P外 例:P时的平衡T,熔点,沸点,晶型转变点 一一为可逆相变 6
6 例: H2 O (l) ⎯T ⎯,P → H2 O (g) T=373K, P*=Pθ=101325Pa T=298K, P*=3168Pa T 体= T 环, P 体=P 环=P 外 例:P θ时的平衡 T,熔点,沸点,晶型转变点 ——为可逆相变 发生在两相平衡共存的 T,P 下的相变 ——可逆相变 ①定义:
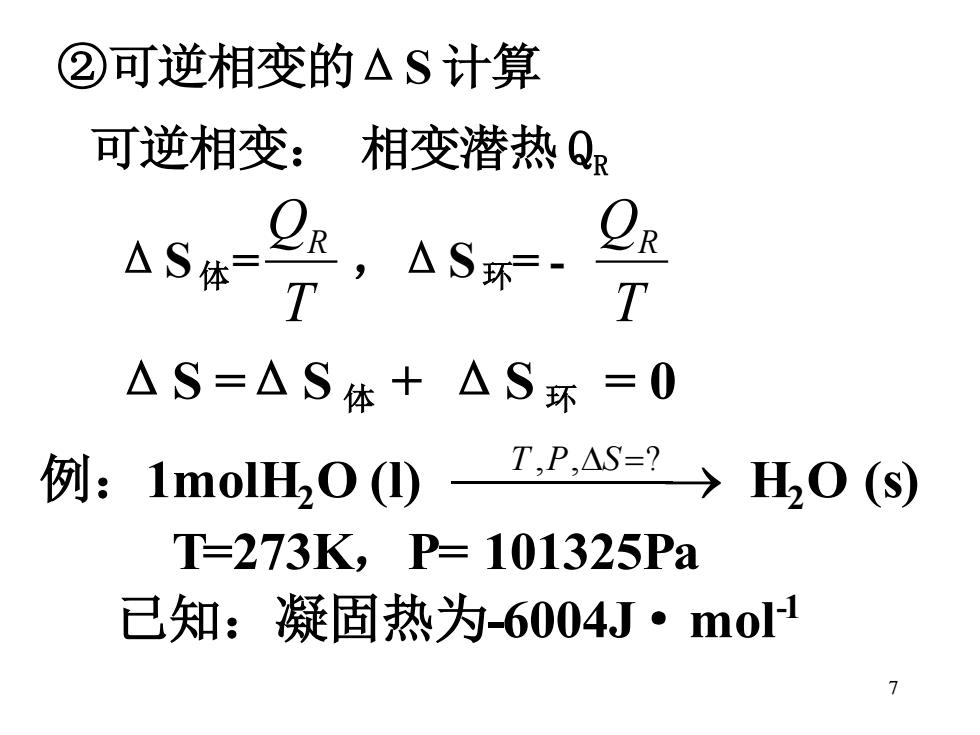
②可逆相变的△S计算 可逆相变:相变潜热Q R,△S环·T T △S=△S体+△S环=0 例:1 moIHO(①) T,P,S=2→H20(S) T=273K,P=101325Pa 已知:凝固热为-6004J·mo1
7 ②可逆相变的ΔS 计算 可逆相变: 相变潜热 QR ΔS 体= T QR ,ΔS 环= - T QR ΔS =ΔS 体 + ΔS 环 = 0 例:1molH2 O (l) ⎯T ⎯,P,S ⎯=? → H2 O (s) T=273K,P= 101325Pa 已知:凝固热为-6004J·mol-1

-6004 △S体= OR =-22J·K4 T 273 △S环2- 2R=22J·K T △S=△S体+△S环=0 2)不可逆相变化 ①定义:不是发生在两相平衡共存的T,P下 的相变一一不可逆相变 亚(介)稳态的变化:过冷、过热的液体; 过饱和溶液等
8 ΔS 体= T QR = 273 − 6004 = - 22 J·K-1 ΔS 环= - T QR =22 J·K-1 ΔS =ΔS 体 + ΔS 环 = 0 2)不可逆相变化 ①定义:不是发生在两相平衡共存的 T,P 下 的相变——不可逆相变 亚(介)稳态的变化:过冷、过热的液体; 过饱和溶液等