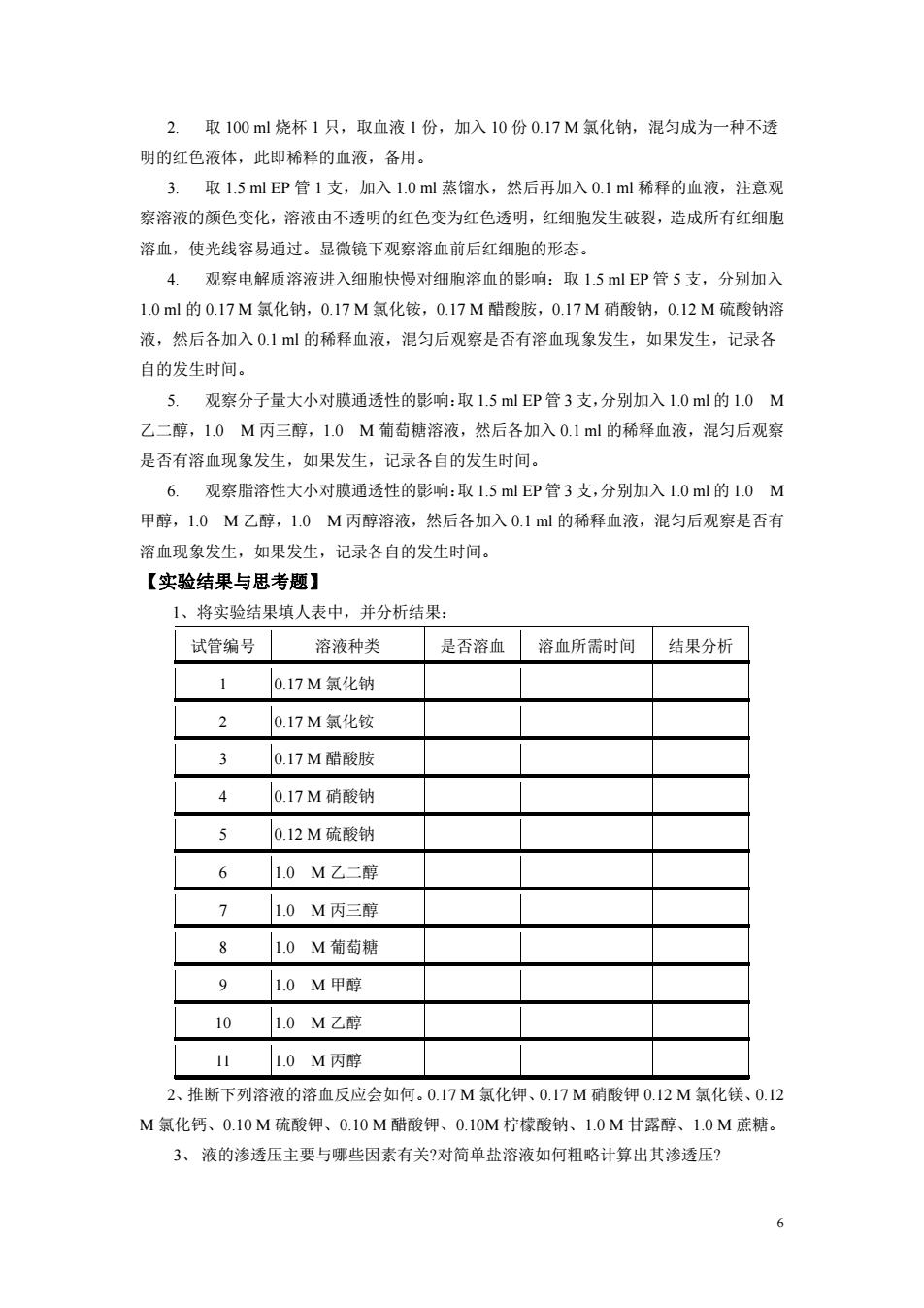
2.取100ml烧杯1只,取血液1份,加入10份0.17M氯化钠,混匀成为一种不透 明的红色液体,此即稀释的血液,备用。 3.取1.5mlEP管1支,加入1.0ml蒸馏水,然后再加入0.1ml稀释的血液,注意观 察溶液的颜色变化,溶液由不透明的红色变为红色透明,红细胞发生破裂,造成所有红细胞 溶血,使光线容易通过。显微镜下观察溶血前后红细胞的形态。 4.观察电解质溶液进入细胞快慢对细胞溶血的影响:取1.5mEP管5支,分别加入 1.0ml的0.17M氯化钠,0.17M氯化铵,0.17M醋酸胺,0.17M硝酸钠,0.12M硫酸钠溶 液,然后各加入0.1ml的稀释血液,混匀后观察是否有溶血现象发生,如果发生,记录各 自的发生时间。 5.观察分子量大小对膜通透性的影响:取1.5mlEP管3支,分别加入1.0ml的1.0M 乙二醇,1.0M丙三醇,1.0M葡萄糖溶液,然后各加入0.1ml的稀释血液,混匀后观察 是否有溶血现象发生,如果发生,记录各自的发生时间。 6.观察脂溶性大小对膜通透性的影响:取15mlP管3支,分别加入10ml的10M 甲醇,1.0M乙醇,1.0M丙醇溶液,然后各加入0.1ml的稀释血液,混匀后观察是否有 溶血现象发生,如果发生,记录各自的发生时间。 【实验结果与思考题】 1、将实验结果填人表中,并分析结果: 试管编号溶液种类 是否溶血溶血所需时间结果分析 1 0.17M氯化钠 2 0.17M氯化铵 3 0.17M醋酸胺 4 0.17M硝酸钠 5 0.12M硫酸钠 6 1.0M乙二醇 7 1.0M丙三醇 1.0M葡萄糖 9 1.0M甲醇 101.0M乙醇 11 1.0M丙醇 2、推断下列溶液的溶血反应会如何.0.17M氯化钾、0.17M硝酸钾0.12M氯化镁、0.12 M氯化钙、0.10M硫酸钾、0.10M醋酸钾、0.10M柠檬酸钠、1.0M甘露醇、1.0M蔗糖。 3、液的渗透压主要与哪些因素有关?对简单盐溶液如何粗略计算出其渗透压?
2. 取 100 ml 烧杯 1 只,取血液 1 份,加入 10 份 0.17 M 氯化钠,混匀成为一种不透 明的红色液体,此即稀释的血液,备用。 3. 取 1.5 ml EP 管 1 支,加入 1.0 ml 蒸馏水,然后再加入 0.1 ml 稀释的血液,注意观 察溶液的颜色变化,溶液由不透明的红色变为红色透明,红细胞发生破裂,造成所有红细胞 溶血,使光线容易通过。显微镜下观察溶血前后红细胞的形态。 4. 观察电解质溶液进入细胞快慢对细胞溶血的影响:取 1.5 ml EP 管 5 支,分别加入 1.0 ml 的 0.17 M 氯化钠,0.17 M 氯化铵,0.17 M 醋酸胺,0.17 M 硝酸钠,0.12 M 硫酸钠溶 液,然后各加入 0.1 ml 的稀释血液,混匀后观察是否有溶血现象发生,如果发生,记录各 自的发生时间。 5. 观察分子量大小对膜通透性的影响:取 1.5 ml EP 管 3 支,分别加入 1.0 ml 的 1.0 M 乙二醇,1.0 M 丙三醇,1.0 M 葡萄糖溶液,然后各加入 0.1 ml 的稀释血液,混匀后观察 是否有溶血现象发生,如果发生,记录各自的发生时间。 6. 观察脂溶性大小对膜通透性的影响:取 1.5 ml EP 管 3 支,分别加入 1.0 ml 的 1.0 M 甲醇,1.0 M 乙醇,1.0 M 丙醇溶液,然后各加入 0.1 ml 的稀释血液,混匀后观察是否有 溶血现象发生,如果发生,记录各自的发生时间。 【实验结果与思考题】 1、将实验结果填人表中,并分析结果: 试管编号 溶液种类 是否溶血 溶血所需时间 结果分析 1 0.17 M 氯化钠 2 0.17 M 氯化铵 3 0.17 M 醋酸胺 4 0.17 M 硝酸钠 5 0.12 M 硫酸钠 6 1.0 M 乙二醇 7 1.0 M 丙三醇 8 1.0 M 葡萄糖 9 1.0 M 甲醇 10 1.0 M 乙醇 11 1.0 M 丙醇 2、推断下列溶液的溶血反应会如何。0.17 M 氯化钾、0.17 M 硝酸钾 0.12 M 氯化镁、0.12 M 氯化钙、0.10 M 硫酸钾、0.10 M 醋酸钾、0.10M 柠檬酸钠、1.0 M 甘露醇、1.0 M 蔗糖。 3、 液的渗透压主要与哪些因素有关?对简单盐溶液如何粗略计算出其渗透压? 6

实验三线粒体的活体染色与观察 【实验目的】 掌握动、植物细胞线粒体活体染色的原理和技术。 【实验原理】 活体染色是指对生活有机体的细胞或 组织能者色,但又无毒害的一种染色方 法。由于碱性染料的胶粒表面带有阳离 子,酸性染料的胶粒表面带有阴离子,而 被染部分本身具有阳离子或阴离子,因此 它们彼此之间发生吸引作用,染料就被堆 积下来,可以显示出活细胞内的某种天然 结构存在的其实性,而不影响细胞的生命 活动和产生任何物理、化学变化以引致细 胞的死亡。活体染色技术可用来研究生活 状态下的细胞结构和生理、病理状态。 活体染色可分为体内活染和体外活 染两种类型。体内活染是将染料溶液以胶 图3线粒体结构模式图 体状态注入动植物体内,染料的颗粒固 定、聚集在细胞内的特殊部位,达到被识别观察的目的。体外活染又称为超活染色,该方法 从活的动、植物体内分离出部分细胞或组织,以染料溶液侵染,染料被选择性地定位在活细 胞的某种结构上而显色。 詹纳斯绿B(Janus Green B)是对线粒体具有专一性的碱性染料,毒性很小,能对动植物 的细胞或组织在活体状态下进行无毒害的染色。詹纳斯绿B有两种状态,氧化态时呈蓝绿色, 还原态时呈无色。詹纳斯绿B染色的原理是利用线粒体中的细胞色素氧化酶系的作用,使詹 纳斯绿B保持氧化状态,呈蓝绿色,可被观察到,而在周围的细胞质中,詹纳斯绿B被还原 成还原状态,呈无色,不能被观察到。 【材料、器具与试剂】 (一)材料:洋葱鳞茎、人口腔上皮细胞,小麦或玉米根尖。 (二)器具:普通光学显微镜、恒温水浴锅,天平,解剖盘、剪刀、镊子、解剖刀、吸管、 载玻片、盖玻片、擦镜纸、吸水纸、牙签,1.5m离心管,量筒,烧杯。 (三)试剂: 1.Ringer溶液:称取氯化钠8.50g,氯化钙0.03g,氯化钾0.25g,溶于蒸馏水,定容至100 2.1%詹纳斯绿B溶液:称取0.5g詹纳斯绿B溶于50 ml Ringeri溶液中,稍加热(30-40C)使 之很快溶解,用滤纸过滤,即成1%溶液,储存备用。 7
实验三 线粒体的活体染色与观察 【实验目的】 掌握动、植物细胞线粒体活体染色的原理和技术。 【实验原理】 活体染色是指对生活有机体的细胞或 组织能着色,但又无毒害的一种染色方 法。由于碱性染料的胶粒表面带有阳离 子,酸性染料的胶粒表面带有阴离子,而 被染部分本身具有阳离子或阴离子,因此 它们彼此之间发生吸引作用,染料就被堆 积下来,可以显示出活细胞内的某种天然 结构存在的真实性,而不影响细胞的生命 活动和产生任何物理、化学变化以引致细 胞的死亡。活体染色技术可用来研究生活 状态下的细胞结构和生理、病理状态。 活体染色可分为体内活染和体外活 染两种类型。体内活染是将染料溶液以胶 体状态注入动植物体内,染料的颗粒固 定、聚集在细胞内的特殊部位,达到被识别观察的目的。体外活染又称为超活染色,该方法 从活的动、植物体内分离出部分细胞或组织,以染料溶液侵染,染料被选择性地定位在活细 胞的某种结构上而显色。 图 3 线粒体结构模式图 詹纳斯绿B(Janus Green B)是对线粒体具有专一性的碱性染料,毒性很小,能对动植物 的细胞或组织在活体状态下进行无毒害的染色。詹纳斯绿B有两种状态,氧化态时呈蓝绿色, 还原态时呈无色。詹纳斯绿B染色的原理是利用线粒体中的细胞色素氧化酶系的作用,使詹 纳斯绿B保持氧化状态,呈蓝绿色,可被观察到,而在周围的细胞质中,詹纳斯绿B被还原 成还原状态,呈无色,不能被观察到。 【材料、器具与试剂】 (一)材料:洋葱鳞茎、人口腔上皮细胞,小麦或玉米根尖。 (二)器具:普通光学显微镜、恒温水浴锅,天平,解剖盘、剪刀、镊子、解剖刀、吸管、 载玻片、盖玻片、擦镜纸、吸水纸、牙签,1.5 ml离心管,量筒,烧杯。 (三)试剂: 1.Ringer溶液:称取氯化钠8.50g,氯化钙0.03g,氯化钾0.25g,溶于蒸馏水,定容至100 ml。 2.1%詹纳斯绿B溶液:称取0.5g詹纳斯绿B溶于50 ml Ringer溶液中,稍加热(30~40℃)使 之很快溶解,用滤纸过滤,即成1%溶液,储存备用。 7

3.1/5000詹纳斯绿B溶液:实验前,取1%詹纳斯绿B溶液1ml,加入49 ml Ring©r溶液混 匀,即成150O0詹纳斯绿B溶液,装入棕色瓶备用。溶液最好现用现配,以保持它的充分氧 化能力。 【方法与步骤】 (一)人口腔上皮细胞的线粒体活体染色观察 1.取干净载玻片1张,滴一滴1/5000詹纳斯绿B溶液。 2.取一根灭菌的干净牙签,实验者用牙签宽头在自己口腔频粘膜处稍用力刮取上皮细胞 (注意:切勿用力过大过猛,以免将口腔刮伤),将牙签头上刮下的粘液状物放入载玻片上 的染液滴中,可轻敲搅动几下,确保牙签上的上皮细胞进入染液滴中。 3.染色15min左右。 4盖上盖玻片,压片,用吸水纸吸去盖玻片周围多余水分,置于显微镜下观察。 5.先在低倍镜下选择平展的上皮细胞,在高倍镜或油镜下观察,可见口腔上皮细胞中的 被染成蓝绿色的呈颗粒状或线条状物质,即为线粒体。在细胞核周围分布特别多。 (二)洋葱鳞茎表皮细胞的线粒体活体染色观察 1取干净载玻片1张,滴一滴1/5000詹纳斯绿B溶液。 2.用镊子撕取洋葱鳞茎内表皮一小片,置于詹纳斯绿B染液中,染色10-15min 3.染色时间到后,吸去多余染液,加一滴Ringer溶液,将洋葱内表皮展平,盖上盖玻片, 压片,用吸水纸吸去盖玻片周围多余水分。 4在显微镜下观察。高倍镜下,可见表皮细胞中央被一大液泡所占据,细胞核和细胞质 被挤至旁边,线粒体染成蓝绿色,呈颗粒状或线条状,集中分布在靠近细胞膜的边缘。 【实验结果与思考题】 1绘图表示线粒体在人口腔上皮细胞和洋葱鳞茎内表皮细胞中的形态和分布,注意比较 两种不同来源细胞的大小比例。 2简述线粒体詹纳斯绿B活体染色的原理」
3.1/5000詹纳斯绿B溶液:实验前,取1%詹纳斯绿B溶液1 ml,加入49 ml Ringer溶液混 匀,即成1/5000詹纳斯绿B溶液,装入棕色瓶备用。溶液最好现用现配,以保持它的充分氧 化能力。 【方法与步骤】 (一)人口腔上皮细胞的线粒体活体染色观察 1.取干净载玻片1张,滴一滴1/5000詹纳斯绿B溶液。 2.取一根灭菌的干净牙签,实验者用牙签宽头在自己口腔颊粘膜处稍用力刮取上皮细胞 (注意:切勿用力过大过猛,以免将口腔刮伤),将牙签头上刮下的粘液状物放入载玻片上 的染液滴中,可轻敲搅动几下,确保牙签上的上皮细胞进入染液滴中。 3.染色15 min左右。 4.盖上盖玻片,压片,用吸水纸吸去盖玻片周围多余水分,置于显微镜下观察。 5.先在低倍镜下选择平展的上皮细胞,在高倍镜或油镜下观察,可见口腔上皮细胞中的 被染成蓝绿色的呈颗粒状或线条状物质,即为线粒体。在细胞核周围分布特别多。 (二)洋葱鳞茎表皮细胞的线粒体活体染色观察 1.取干净载玻片1张,滴一滴1/5000詹纳斯绿B溶液。 2.用镊子撕取洋葱鳞茎内表皮一小片,置于詹纳斯绿B染液中,染色10~15min。 3.染色时间到后,吸去多余染液,加一滴Ringer溶液,将洋葱内表皮展平,盖上盖玻片, 压片,用吸水纸吸去盖玻片周围多余水分。 4.在显微镜下观察。高倍镜下,可见表皮细胞中央被一大液泡所占据,细胞核和细胞质 被挤至旁边,线粒体染成蓝绿色,呈颗粒状或线条状,集中分布在靠近细胞膜的边缘。 【实验结果与思考题】 1.绘图表示线粒体在人口腔上皮细胞和洋葱鳞茎内表皮细胞中的形态和分布,注意比较 两种不同来源细胞的大小比例。 2.简述线粒体詹纳斯绿B活体染色的原理。 8

实验四线粒体的分离制备与观察 【实验目的】 1.了解差速离心技术的原理 2.掌握线粒体的差速离心分离技术。 【实验原理】 差速离心(difriifution)是利用不同物质颗粒沉降系数的差别,由低速向高 速离心时,各种沉降系数不同的颗粒可先后分批沉淀下来,达到分离的目的。沉降系数差别 在一个或几个数量级的颗粒,可以用差速离心法分离,该方法简单,但分辨率不高,沉淀系 数在同一个数量级内的各种粒子不容易分开,常用于其他分离手段之前的粗制品提取。差速 离心用到的仪器为离心机,一般认为,转速为10-25Kmin的离心机称为高速离心机:转速 低于1 0Kr/min的离心机称为低速离心机:转速超过25 Kr/min的离心机称为超速离心机。目 前超速离心机的最高转速可达1O0 Kr/min,离心力超过500Kg。 ●9 Time 图4两种不同的离心分离方式。左图为差速离心,右图为密度梯度离心 采用差速离心方法,在密度均一的介质中由低速到高速逐级离心,可用于分离不同大小 的细胞和细胞器。在差速离心中细胞器沉降的顺序依次为:核、线粒体、溶酶体与过氧化物 酶体、内质网与高基体、最后为核蛋白体和大分子。通过差速离心可将细胞器初步分离,常 需进一步通过密度梯离心再行分离纯化。 线粒体是真核细胞特有的进行能量转换的重要细胞器。将动植物组织制成匀浆,在适当 的悬浮介质中差速离心法可以分离细胞线粒体。悬浮介质通常采用缓冲的燕糖溶液,它较接 近细胞质的分散相,在一定程度上能保持细胞器的结构和酶的活性:pH7.2的条件下,亚细 胞组分不容易聚集成团,有利于分离。整个操作过程样品要保持在4℃,避免酶失活。 线粒体的检测鉴定采用詹纳斯绿B(Janus green B)染色观察。线粒体内膜上分布有细胞 色素氧化酶,该酶使詹纳斯绿B染料保持在氧化状态呈现蓝绿色,从而使线粒体显色,而 胞质中的染料被还原成无色。 【材料、器具与试剂】 (一)材料:玉米黄化苗,猪肝脏等。 9
实验四 线粒体的分离制备与观察 【实验目的】 1.了解差速离心技术的原理 2.掌握线粒体的差速离心分离技术。 【实验原理】 差速离心(differential centrifugation) 是利用不同物质颗粒沉降系数的差别,由低速向高 速离心时,各种沉降系数不同的颗粒可先后分批沉淀下来,达到分离的目的。沉降系数差别 在一个或几个数量级的颗粒,可以用差速离心法分离,该方法简单,但分辨率不高,沉淀系 数在同一个数量级内的各种粒子不容易分开,常用于其他分离手段之前的粗制品提取。差速 离心用到的仪器为离心机,一般认为,转速为 10~25Kr/min 的离心机称为高速离心机;转速 低于 10Kr/min 的离心机称为低速离心机;转速超过 25Kr/min 的离心机称为超速离心机。目 前超速离心机的最高转速可达 100Kr/min,离心力超过 500Kg。 图 4 两种不同的离心分离方式。左图为差速离心,右图为密度梯度离心 采用差速离心方法,在密度均一的介质中由低速到高速逐级离心,可用于分离不同大小 的细胞和细胞器。在差速离心中细胞器沉降的顺序依次为:核、线粒体、溶酶体与过氧化物 酶体、内质网与高基体、最后为核蛋白体和大分子。通过差速离心可将细胞器初步分离,常 需进一步通过密度梯离心再行分离纯化。 线粒体是真核细胞特有的进行能量转换的重要细胞器。将动植物组织制成匀浆,在适当 的悬浮介质中差速离心法可以分离细胞线粒体。悬浮介质通常采用缓冲的蔗糖溶液,它较接 近细胞质的分散相,在一定程度上能保持细胞器的结构和酶的活性;pH7.2 的条件下,亚细 胞组分不容易聚集成团,有利于分离。整个操作过程样品要保持在 4℃,避免酶失活。 线粒体的检测鉴定采用詹纳斯绿 B(Janus green B)染色观察。线粒体内膜上分布有细胞 色素氧化酶,该酶使詹纳斯绿 B 染料保持在氧化状态呈现蓝绿色,从而使线粒体显色,而 胞质中的染料被还原成无色。 【材料、器具与试剂】 (一)材料:玉米黄化苗,猪肝脏等。 9

(二)器具:冷冻高速离心机,研体,玻璃匀浆器,普通光学显微镜,天平,恒温水浴锅 解剖盘、剪刀、镊子、解剖刀、吸管、载玻片、盖玻片、擦镜纸、吸水纸、1.5m离 心管,量筒,烧杯。 (三)试剂: 1.Ringer溶液:称取氯化钠8.50g,氯化钙0.03g,氯化钾0.25g,溶于燕馏水,定容至100 ml。 2.1%詹纳斯绿B溶液:称取0.5g詹纳斯绿B溶于50 ml Ringer溶液中,稍加热(3040C)使 之很快溶解,用滤纸过滤,即成1%溶液,储存备用。 3.1/5000詹纳斯绿B溶液:实验前,取1%詹纳斯绿B溶液1ml,加入49 ml Ringeri溶液混 匀,即成1/50O0詹纳斯绿B溶液,装入棕色瓶备用。溶液最好现用现配,以保持它的充分氧 化能力。 4.1.0M的Tis-HCI缓冲液(pH7.4):称量12.11gTis置于烧杯中,加入约80ml的去离子 水,充分搅拌溶解。然后加入浓HC约7.0m将pH调至7.4,将溶液定容至100ml,高温高压 灭葡后,室温保存备用。 5.0.5 M EDTA(pH8.0)溶液:称取18.61 gNacEDTA·2HO,置于烧杯中,加入约80ml 的去离子水,充分搅拌。用NaOH调节pH值至8.0(约20 g NaOH),注意:pH值至8.O时, EDTA才能完全溶解。加去离子水将溶液定容至1O0ml,高温高压灭菌,室温保存备用。 6.线粒体分离介质(0.25M蔗糖,50 mM Tris-HCl,3 mM EDTA,0.75 g/LBSA):称 取燕糖85.5g,取1.0M的Tris-HCI缓冲液(pH74)50ml,0.5 M EDTA(pH80)溶液6ml,加 入0.75g牛血清白蛋白(BSA),加入蒸馏水,溶解,定容至1L,备用。 7.线粒体保存液(0.3M甘露醇,pH7.4):称取甘露醇5.46g,溶于蒸馏水中,调节pH 至7.4,然后定容至100ml,备用。 80.9%生理盐水:称取9克氯化钠,溶解在蒸馏水中,定容到1L。 9.0.25M蔗糖溶液:称取蔗糖85.5g,加入蒸馏水,溶解,定容至1L。 10.20%次氯酸钠溶液。 【实验步骤】 一、动物肝脏线粒体的分离 1,制备肝细胞匀浆:取动物肝脏,迅速用生理盐水洗净血水,用滤纸吸干水分,称取 肝组织1g,剪碎:用预冷的0.25M蔗糖溶液洗涤数次。然后按每克肝加9ml预冷的0,25M 燕糖溶液的量,分数次添加蔗糖溶液,在0℃4℃冰浴中用玻璃匀浆器将肝组织制成匀浆。 2.取匀浆液1.5ml于1.5ml的Ep管中,置于冷冻离心机中,以2500pm离心10min 3.取1.0ml上清转入新EP管中,置于冷冻离心机中,以100O0rpm离心10min,弃 上清,得到沉淀即为线粒体。 4.加入预冷的0.25M蔗糖溶液1.5ml,摇匀洗涤后,10000pm离心5min,弃上清 重复两次
(二)器具:冷冻高速离心机,研钵,玻璃匀浆器,普通光学显微镜,天平,恒温水浴锅, 解剖盘、剪刀、镊子、解剖刀、吸管、载玻片、盖玻片、擦镜纸、吸水纸、1.5 ml 离 心管,量筒,烧杯。 (三)试剂: 1.Ringer溶液:称取氯化钠8.50g,氯化钙0.03g,氯化钾0.25g,溶于蒸馏水,定容至100 ml。 2.1%詹纳斯绿B溶液:称取0.5g詹纳斯绿B溶于50 ml Ringer溶液中,稍加热(30~40℃)使 之很快溶解,用滤纸过滤,即成1%溶液,储存备用。 3.1/5000詹纳斯绿B溶液:实验前,取1%詹纳斯绿B溶液1 ml,加入49 ml Ringer溶液混 匀,即成1/5000詹纳斯绿B溶液,装入棕色瓶备用。溶液最好现用现配,以保持它的充分氧 化能力。 4.1.0 M的Tris-HCl缓冲液(pH7.4):称量12.11g Tris置于烧杯中,加入约80 ml的去离子 水,充分搅拌溶解。然后加入浓HCl约7.0 ml将pH调至7.4,将溶液定容至100 ml,高温高压 灭菌后,室温保存备用。 5.0.5 M EDTA(pH 8.0)溶液:称取18.61 g Na2EDTA·2H2O,置于烧杯中,加入约80 ml 的去离子水,充分搅拌。用NaOH调节pH值至8.0(约20 g NaOH),注意:pH值至8.0时, EDTA才能完全溶解。加去离子水将溶液定容至100 ml,高温高压灭菌,室温保存备用。 6.线粒体分离介质(0.25 M蔗糖,50 mM Tris-HCl,3 mM EDTA,0.75 g/L BSA):称 取蔗糖85.5 g,取1.0 M的Tris-HCl缓冲液(pH7.4)50 ml,0.5 M EDTA(pH 8.0)溶液6 ml,加 入0.75 g牛血清白蛋白(BSA),加入蒸馏水,溶解,定容至1 L,备用。 7.线粒体保存液(0.3 M甘露醇,pH 7.4):称取甘露醇5.46g,溶于蒸馏水中,调节pH 至7.4,然后定容至100 ml,备用。 8.0.9%生理盐水:称取9克氯化钠,溶解在蒸馏水中,定容到1 L。 9.0.25M蔗糖溶液:称取蔗糖85.5 g,加入蒸馏水,溶解,定容至1 L。 10.20%次氯酸钠溶液。 【实验步骤】 一、动物肝脏线粒体的分离 1.制备肝细胞匀浆:取动物肝脏,迅速用生理盐水洗净血水,用滤纸吸干水分,称取 肝组织 1 g,剪碎;用预冷的 0.25M蔗糖溶液洗涤数次。然后按每克肝加 9 ml预冷的 0.25M 蔗糖溶液的量,分数次添加蔗糖溶液,在 0℃~4℃冰浴中用玻璃匀浆器将肝组织制成匀浆。 2. 取匀浆液 1.5 ml 于 1.5 ml 的 EP 管中,置于冷冻离心机中,以 2500 rpm 离心 10 min。 3.取 1.0 ml 上清转入新 EP 管中,置于冷冻离心机中,以 10 000 rpm 离心 10 min,弃 上清,得到沉淀即为线粒体。 4.加入预冷的 0.25M 蔗糖溶液 1.5 ml,摇匀洗涤后,10 000 rpm 离心 5 min,弃上清。 重复两次。 10