
3、键角(bond angle) 分子中同一原子形成的两个化学键间的夹角称为键角。 对于多原子分子,由于分子中的原子在空间排布情 况不同就有不同的几何构型。 请看下表:
3、键角(bond angle) 分子中同一原子形成的两个化学键间的夹角称为键角。 对于多原子分子,由于分子中的原子在空间排布情 况不同就有不同的几何构型。 请看下表:
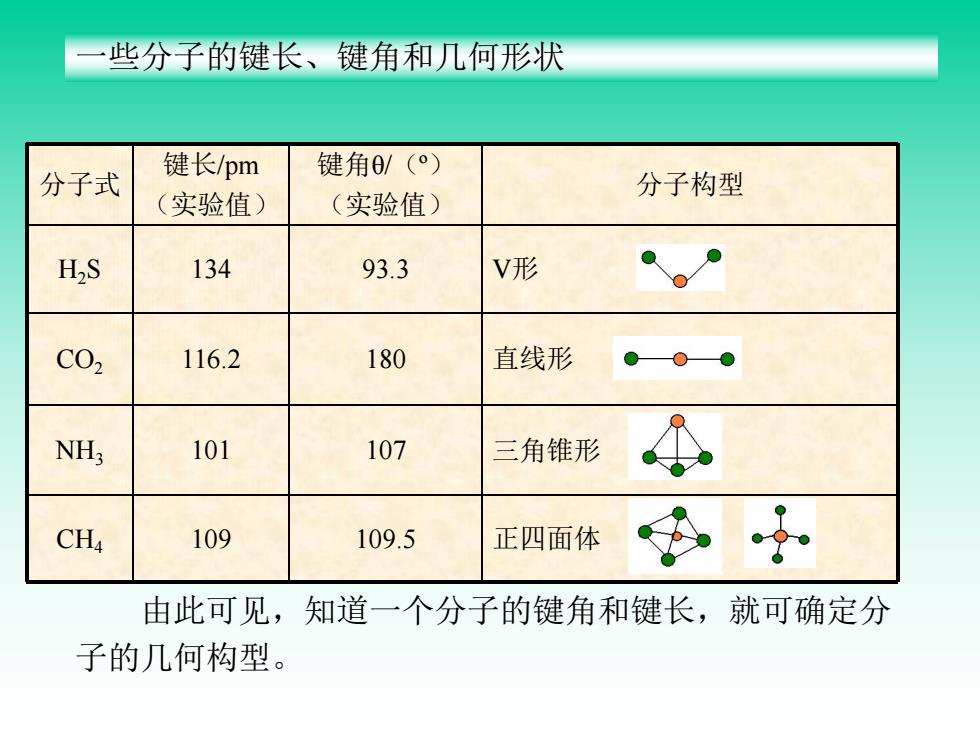
些分子的键长、键角和几何形状 键角0/(°) 分子式 键长/pm 实验值) (实验值) 分子构型 H2S 134 93.3 V形 C02 116.2 180 直线形 NH; 101 107 三角锥形 CH4 109 109.5 正四面体 由此可见,知道一个分子的键角和键长,就可确定分 子的几何构型
一些分子的键长、键角和几何形状 分子式 键长/pm (实验值) 键角θ/(º) (实验值) 分子构型 H2S 134 93.3 V形 CO2 116.2 180 直线形 NH3 101 107 三角锥形 CH4 109 109.5 正四面体 由此可见,知道一个分子的键角和键长,就可确定分 子的几何构型

三、 杂化轨道理论 (一)、杂化轨道理论的要点 1.在成键过程中,由于原子间的相互影响,同一原子中 几个能量相近的不同类型的原子轨道,可以进行组合,重新 分配能量和确定空间方向,组成数目相等的新的原子轨道, 这种轨道重新组合的过程称为杂化(hybridization),杂 化后形成的新轨道称为杂化轨道(hybrid orbital) 2.杂化轨道改变了原子轨道的形状,杂化轨道一头大, 一头小,更有利于原子轨道间最大程度重叠,因而杂化轨道 比原来轨道的成键能力强。 3.不同的原子轨道可以杂化成不同类型的杂化轨道,不 同类型的杂化轨道之间的夹角不同,成键后所形成的分子就 具有不同的空间构型
三、杂化轨道理论 (一)、杂化轨道理论的要点 1.在成键过程中,由于原子间的相互影响,同一原子中 几个能量相近的不同类型的原子轨道,可以进行组合,重新 分配能量和确定空间方向,组成数目相等的新的原子轨道, 这种轨道重新组合的过程称为杂化(hybridization),杂 化后形成的新轨道称为杂化轨道(hybrid orbital)。 2.杂化轨道改变了原子轨道的形状,杂化轨道一头大, 一头小,更有利于原子轨道间最大程度重叠,因而杂化轨道 比原来轨道的成键能力强。 3.不同的原子轨道可以杂化成不同类型的杂化轨道,不 同类型的杂化轨道之间的夹角不同,成键后所形成的分子就 具有不同的空间构型

(二)S和D原子杂化轨道的类型及实例 能量相近的ns轨道和p轨道之间的杂化称为sp型杂化。 (分sp、Sp2、sp3三种)
(二)s和p原子杂化轨道的类型及实例 能量相近的 ns 轨道和 np 轨道之间的杂化称为 sp型杂化。 (分sp、sp2 、sp3三种)
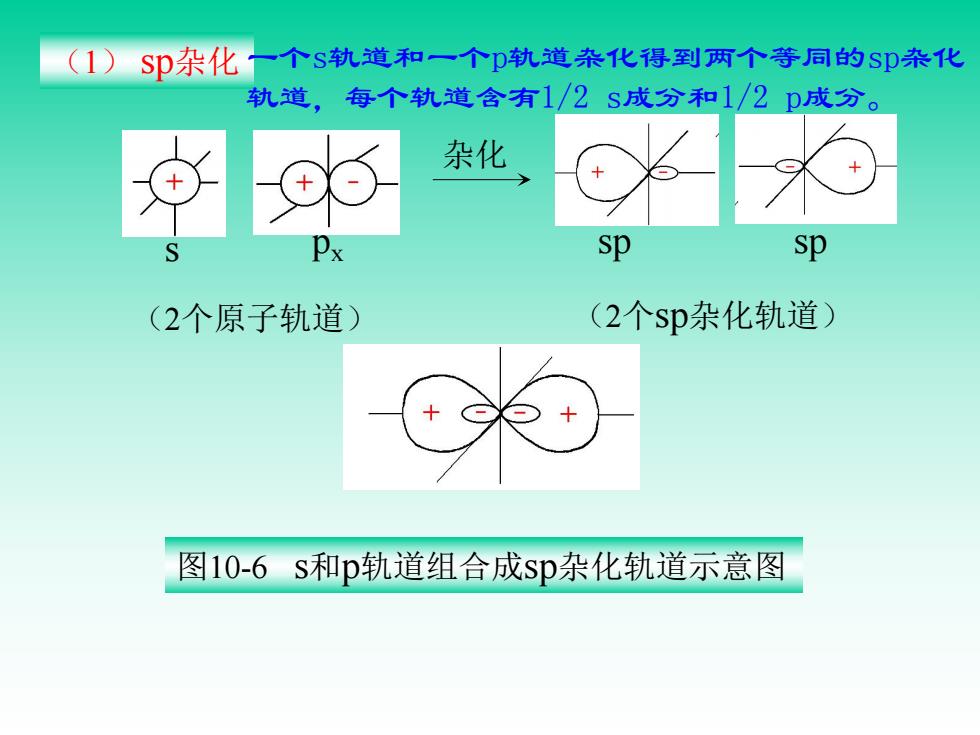
(1) Sp杂化一个S轨道和一个D轨道杂化得到两个等同的Sp条化 轨道,每个轨道含有1/2s成分和1/2p成分。 杂化 sp sp (2个原子轨道) (2个sp杂化轨道) 图10-6s和p轨道组合成sp杂化轨道示意图
(1) sp杂化 杂化 sp sp (2个sp杂化轨道) 图10-6 s和p轨道组合成sp杂化轨道示意图 (2个原子轨道) s px 一个s轨道和一个p轨道杂化得到两个等同的sp杂化 轨道,每个轨道含有1/2 s成分和1/2 p成分