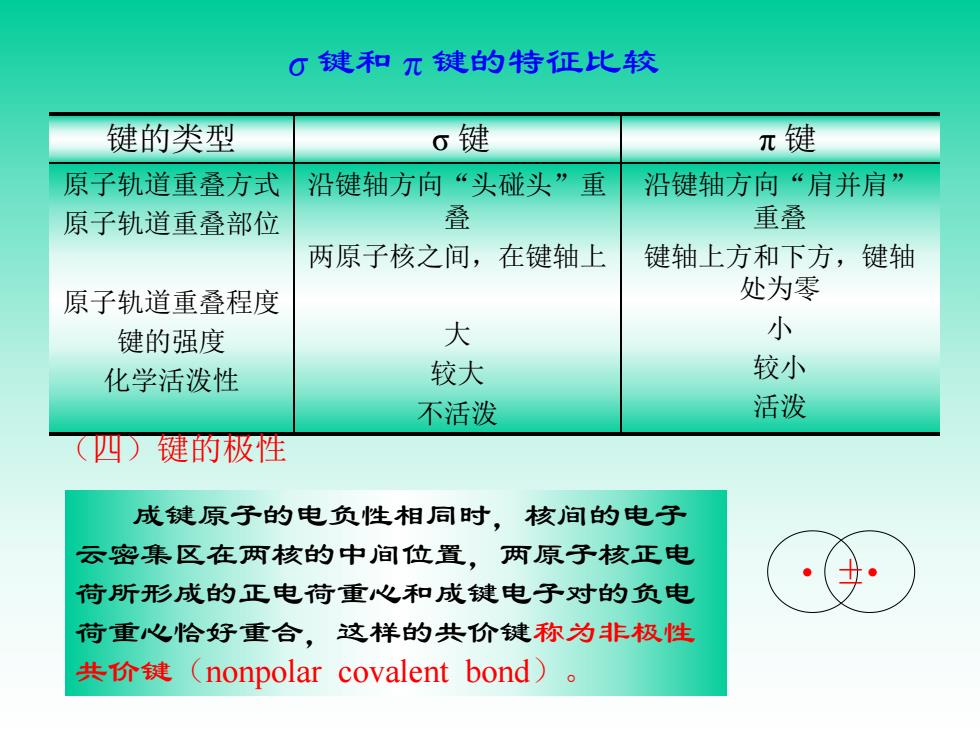
G键和元键的特征比较 键的类型 σ键 π键 原子轨道重叠方式 沿键轴方向“头碰头”重 沿键轴方向“肩并肩” 原子轨道重叠部位 叠 重叠 两原子核之间,在键轴上 键轴上方和下方,键轴 原子轨道重叠程度 处为零 键的强度 大 小 化学活泼性 较大 较小 不活泼 活泼 四)键的极性 成键原子的电负性相同时,核间的电子 云密集区在两核的中间位置,两原子核正电 荷所形成的正电荷重心和成键电子对的负电 荷重心恰好重合,这样的共价键称为非极性 共价键(nonpolar covalent bond)
σ键和π键的特征比较 键的类型 σ 键 π 键 原子轨道重叠方式 原子轨道重叠部位 原子轨道重叠程度 键的强度 化学活泼性 沿键轴方向“头碰头”重 叠 两原子核之间,在键轴上 大 较大 不活泼 沿键轴方向“肩并肩” 重叠 键轴上方和下方,键轴 处为零 小 较小 活泼 (四)键的极性 成键原子的电负性相同时,核间的电子 云密集区在两核的中间位置,两原子核正电 荷所形成的正电荷重心和成键电子对的负电 荷重心恰好重合,这样的共价键称为非极性 共价键(nonpolar covalent bond)。 • ±•

如:H2、02等。 成键原子的电负性不同时,核间的电子 云密集区偏向电负性较大的原子一端,使之 带部分负电荷,电负性较小的原子一端带部 分正电荷,键的正电荷重心和负电荷重心不 重合,这样的共价键称为极性共价键(polar covalent bond)。 如:HCI、HBr等
成键原子的电负性不同时,核间的电子 云密集区偏向电负性较大的原子一端,使之 带部分负电荷,电负性较小的原子一端带部 分正电荷,键的正电荷重心和负电荷重心不 重合,这样的共价键称为极性共价键(polar covalent bond)。 + – 如:H2、O2等。 如:HCl、HBr等
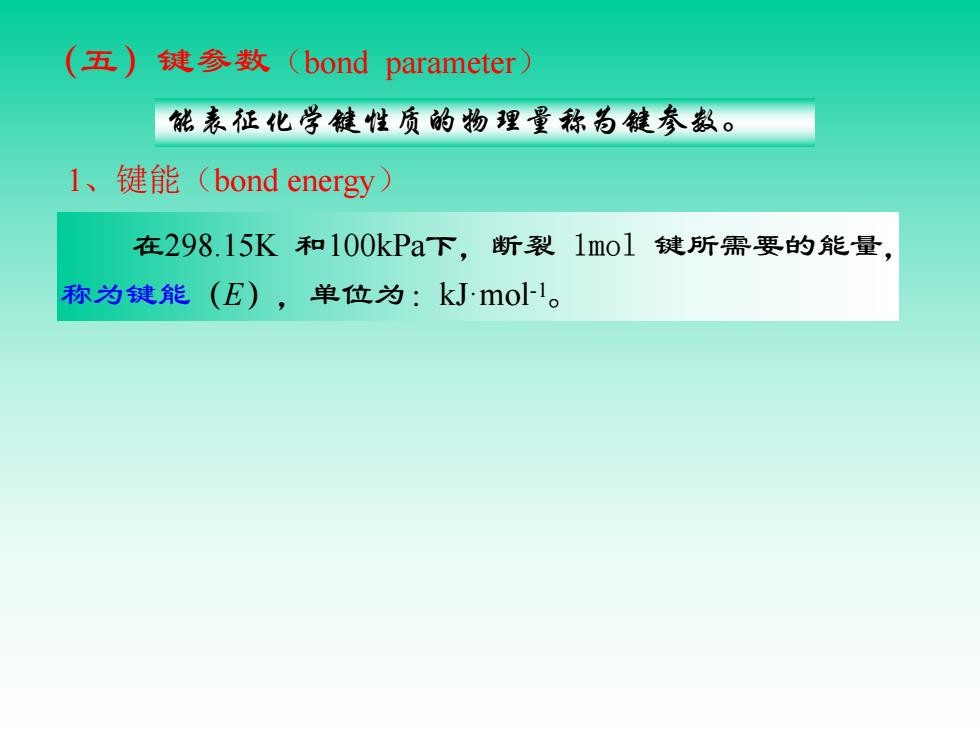
(五)键参数(bond i parameter 能表征化学键性质的物理量称为键参数。 l、键能(bond energy) 在298.15K和100kPa下,断裂1mo1键所需要的能量, 称为键能(E),单位为:kJmol-1
(五)键参数(bond parameter) 1、键能(bond energy) 能表征化学键性质的物理量称为键参数。 在298.15K 和100kPa下,断裂 1mol 键所需要的能量, 称为键能(E),单位为:kJ·mol -1

表10-1一些双原子分子的键能和某些键的平均键能E/kJmo1 分子 键能 分子 平均 平均 键能 共价键 共价键 名称 名称 键能 键能 H2 436 HF 565 C-H 413 N-H 391 F2 165 HCI 431 C-F 460 N-N 159 Cl2 247 HBr 366 C-CI 335 N=N 418 Br2 193 HI 299 C-Br 289 N=N 946 2 151 NO 286 C-I 230 0-0 143 N2 946 Co 1071 C-C 346 0=0 495 02 493 C=C 610 O-H 463 C=C 835
表10-1 一些双原子分子的键能和某些键的平均键能E/kJ·mol -1 分子 名称 键能 分子 名称 键能 共价键 平均 键能 共价键 平均 键能 H2 436 HF 565 C–H 413 N–H 391 F2 165 HCl 431 C–F 460 N–N 159 Cl2 247 HBr 366 C–Cl 335 N=N 418 Br2 193 HI 299 C–Br 289 NN 946 I2 151 NO 286 C–I 230 O–O 143 N2 946 CO 1071 C–C 346 O=O 495 O2 493 C=C 610 O–H 463 CC 835

2、键长(bond length) 分子中两成键原子的核间平衡距离称为键长。 两原子形成的同型共价键的键长越短,键越牢固。就相 同的两原子形成的键而言,单键键长)双键键长〉叁键键长。 例如:C=C键长为134pm;C=C键长为120pm
2、键长(bond length) 分子中两成键原子的核间平衡距离称为键长。 两原子形成的同型共价键的键长越短,键越牢固。就相 同的两原子形成的键而言,单键键长>双键键长>叁键键长。 例如:C=C 键长为134pm;CC 键长为120pm