
d 第八章电帮质带液黎 为阴极,这是在电化学中公认的约定①。但是在电极上究竟发生什么反应,这与 电解质的种类、溶剂的性质、电极材料、外加电源的电压、离子浓度以及温度等有 关。例如,若用惰性电极电解Na2SO,溶液, 在阴极(还原作用):2H+(aq)+2e→H2(g) 在阳极(氧化作用):20H.(aq)一H,0(D+0:(g)+2e 因为溶液中的正离子H+较Na+更易于在阴极放电,Nat只是移向阴极但并不 在阴极放电。同样,在阳极上起作用的是水中的OH,而不是SO,但SO 也移向阳极而参与导电。又如在用惰性电极电解FεCl,溶液时,在阴极上Fe3+ 也可以进行Fe+十e →Fe2+的还原反应。在电解CuCl,溶液时,若溶液浓 度很稀,阳极上可能发生OH的氧化而不是C的氧化:若用Cu为电极,则在 阳极可能发生下述反应: Cu(电极材料)→Cu2+(aq)+2e Faraday电解定律 Faraday(法拉第)归纳了多次实验的结果,于1833年总结出了一条基本定 律,称为Faraday电解定律(Faraday's law of electrolysis),即通电于电解质溶液 之后,(1)在电极上(即两相界面上)物质发生化学变化的物质的量与通人的电 荷量成正比:(2)若将几个电解池串联,通人一定的电荷量后,在各个电解池的 电极上发生化学变化的物质的量都相等。 人们把1mol元电荷的电荷量称为Faraday常数,用F表示 F=Le =6.022×1023mol×1.6022×10-19C =96 484.5 C-mol-196 500 C.mol-1 式中L为Avogadro常数,e是元电荷的电荷量, 如果在电解池中发生如下的反应: M++z+e →M(s) 式中ε代表电子,z+是电极反应中电子转移的计量系数。如欲从该溶液中沉 ①在物理学中认为,电子在电场作用下发生定向移动而显示电流,并规定:以正电荷的运动方向为 电流的方向,且电流总是从电势高的正极流向电势低的负极,这与电子的流向刚好相反。按照这一规定, 在Daniell电池中电子在外电路中是从Za极流向Cu极,而“电流”则是从Cu极流向Za极,即称Cu极是 正极,称Z极是负极,这就是有人也常常用正,负极来表示原电池中两个电极的原因。在本书中采用电 化学中公认的规定

¢58:1电化学中的幕本概念和电解定潭5 积出1mol金属M(s),若反应进度为1mol时,需通入电荷量为: Qu-1=z+eL-z+F 若反应进度为时,需通入电荷量为: Q和=z+FE 若通入任意电荷量Q时,则沉积出金属B的物质的量n和质量m分别为: (8.1a) mMs (8.1b) 式中M是金属B的摩尔质量。式(8.1a)和式(8.1b)就是Faraday电解定律的 数学表达式。 根据电学上的有关计量关系,电流强度I=dQ/,所以 Q-ldr 若电流强度是稳定的,则Q=11。 根据Faraday定律,通过分析电解过程中反应物(或生成物)在电极上物质 的量的变化,就可求出通入电荷量的数值[通常是在电路中串联一个电解池,根 据电解池中在阴极上析出金属的物质的量来计算通入的电荷量,这种装置就称 为电荷量计或库仑计(coulomb meter)]。 例题用强度为0.025A(A=C·s)的电流通过硝酸金[Au(NO),]溶液, 当阴极上有1.20gAu(s)析出时,试计算:(1)通过多少电荷量?(2)需通电多长 时间?(3)阳极上放出氧气的质量。已知Au(s)的摩尔质量为197.0gmol, M(02)为32.0gmol- 解1若电极反应表示为: 阴极 Au*+e一3Au(s) 阳极 2H,O(I)→O,(g)+H+e 当阴极上析出1.20gAu(s)时的反应进度为: =1.20g 1.20g =0.0183mol MgAu)吉×197.0 zmol- (1)Q=:Fe=1×96500Cmol×0.0183mol=1766C

6男八重电系质路石务 (21-9-025C-.06×10 (3)阳极上的反应进度也是0.0183mol,析出氧气的质量为: 0.0183mol×M(0,)=0.0183mol××32.0gmol =0.146g 可见,虽然两个电极反应进度相同,电极反应中转移的电荷数也相同,但A(s 的摩尔质量远大于O,(g),故析出Au(s)的质量也多得多。 解2若电极反应表示为: 阴极Au+(aq)+3e→Au(s) 阳极2H,0一0.(g)+3H+3e 当阴极上析出1.20gAu(s)时的反应进度为: 1.20g 专197.0ga=6.09X103mol (1)Q=zFe=3×96500Cmol×6.09×103mol=1766C (2)1=9=7.06X10s (3)m(02)=6.09×10-3mol×3×32.0gmol1=0.146g 可见,电极反应写法不同,析出相同质量Au(s)的反应进度不同,而三个计 算所得的结果是一样的。 Faraday定律在任何温度和压力下均可适用,没有使用的限制条件。而且 实验愈精确,所得结果与Faraday定律吻合愈好,此类定律在科学上并不多见。 在实际电解时,电极上常发生副反应或次级反应。例如镀锌时,在阴极上除 了进行锌离子的还原反应外,同时还可能发生氢离子还原的副反应。又例如电 解食盐溶液时,在阳极上所生成的氯气,有一部分溶解在溶液中发生次级反应而 生成次氯酸盐和氯酸盐。因此要析出一定数量的某一物质时,实际上所消耗的 电荷量要比按照Faraday定律计算所需的理论电荷量多一些。此两者之比称为 电流效率,通常用百分数来表示:当析出一定数量的某物质时, 电流效率一按Faraday定律计算所需理论电荷量×1o0% 实际所消耗的电荷量 或者当通过一定电荷量后 电极上产物的实际质量 电流效率一按Farad品y定律计算位获得的产物质量X10%

众58.2离子的电迁移率和迁移数 7 例题需在10×10cm的薄铜片两面镀上0.005cm厚的Ni层[镀液用 N(NO,):溶液],假定镀层均匀分布,用2.0A的电流得到上述厚度的镍层需通 电多长时间?设电流效率为96.0%。已知金属镍的密度为8.9gcm,Ni(s) 的摩尔质量为58.69gmol'。 解由极反应为 N+(aq)+2e—Ni(s) 镀层中含Ni(s)的质量为: 10×10cm×2×0.005cm×8.9g°cm3=8.9g 按所写电极反应,析出8.9gNi(s)的反应进度为: 8.9 58.69g mol T=0.152 mol 理论用电荷量为: Q=xF=2×96500Cmol1×0.152mol=2.9×10C 实际用电荷量为:Q(实际)=29X10C-3.0×10C 0.96 通电时间为:-Q实际2-子0X10C-1.5×10.2h 2.0Cs §8.2离子的电迁移率和迁移数 离子的电迁移现象 离子在外电场的作用下发生定向运动称为离子的电迁移(electromigra- tio)。当通电于电解质溶液之后,溶液中承担导电任务的阴、阳离子分别向阳、 阴两极移动,并在相应的两电极界面上发生氧化或还原作用,从而两极旁溶液的 浓度也发生变化。这个过程可用图8.3来示意说明。 设想在两个惰性电极之间的溶液中,有想象的平面AA和BB,将溶液分为 阳极部、中部及阴极部三个部分。假定在未通电前,各部分均含有都为一价的 正,负离子各5mol,分别用十,一号的数量来表示正、负离子的物质的量。今有 4mol电子的电荷量通过之后,在阳极上有4mol负离子发生氧化反应,同时在 阴极上有4m©!正离子发生还原反应,在溶液中的离子也同时发生迁移。当溶 液中通过4m!电子的电荷量时整个导电任务是由正、负离子共同分担的,每种 离子所迁移的电荷量随着它们迁移的速率不同而不同(因已设离子所带的电荷
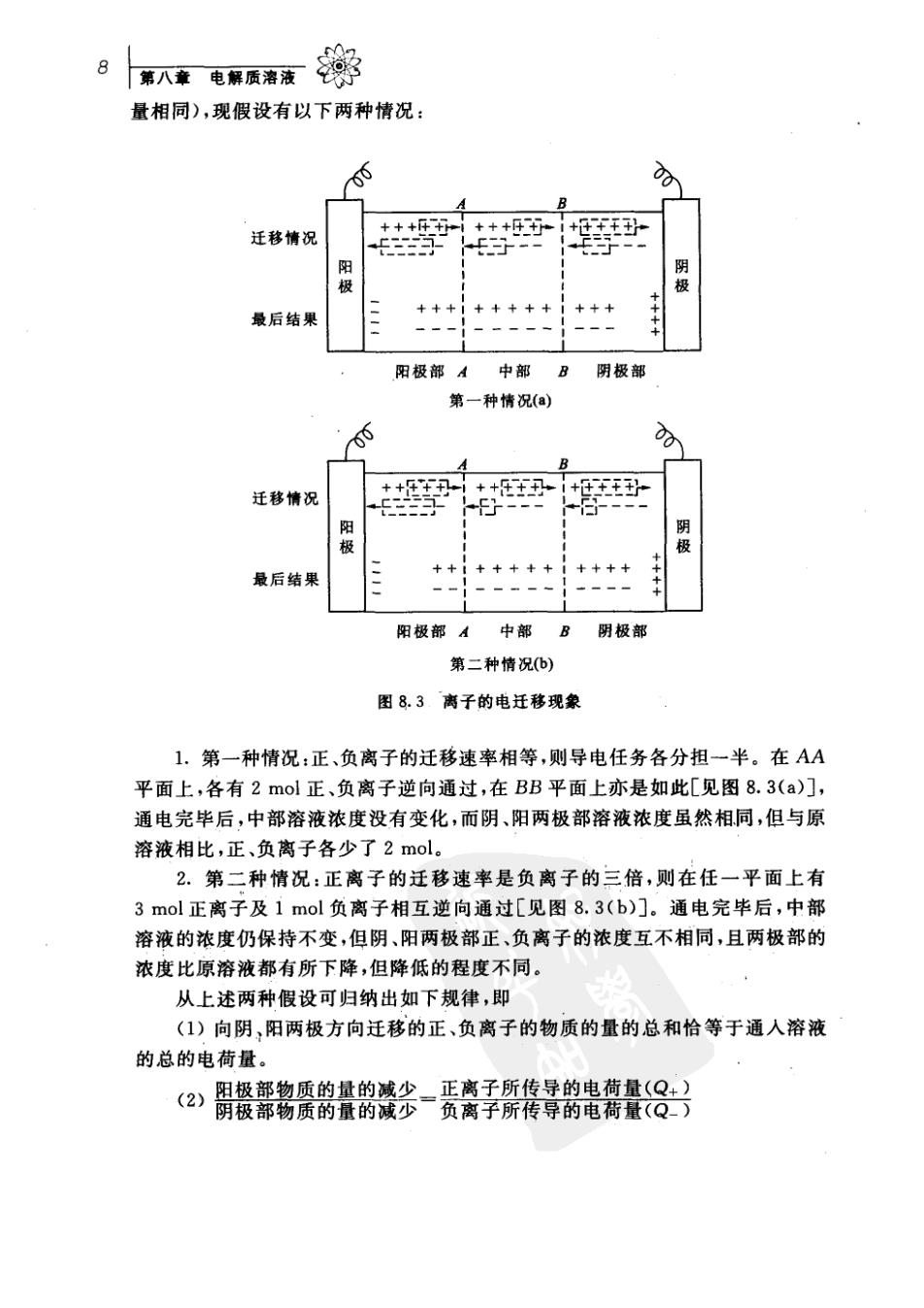
第入章电解质溶液学 量相同),现假设有以下两种情况: 00 迁移情况 ++行 阳 最后结果 ++ 阳极部A中部 B阴极部 第一种情况(a) 00 B 迁移情况 ++ ++ +王 阳极 阴极 ++++ 最后结果 阳极部A中部B阴极部 第二种情况b) 图83离子的电迁移现象 1.第一种情况:正、负离子的迁移速率相等,则导电任务各分担一半。在AA 平面上,各有2mol正、负离子逆向通过,在BB平面上亦是如此[见图8.3(a)], 通电完毕后,中部溶液浓度没有变化,而阴、阳两极部溶液浓度虽然相同,但与原 溶液相比,正、负离子各少了2mol。 2.第二种情况:正离子的迁移速率是负离子的三倍,则在任一平面上有 3mol正离子及1mol负离子相互逆向通过[见图8.3(b)门。通电完毕后,中部 溶液的浓度仍保持不变,但阴、阳两极部正,负离子的浓度互不相同,且两极部的 浓度比原溶液都有所下降,但降低的程度不同。 从上述两种假设可归纳出如下规律,即 (1)向阴,阳两极方向迁移的正、负离子的物质的量的总和恰等于通人溶液 的总的电荷量。 (②)閤餐霈鸛然餐鹄瓷多-赁离子厥格琴鹤餐8