
主要教学内容(注明:*重点#难点):$5.5二组分系统的相图及其应用(未完)(1)杠杆规则(2)蒸馏的基本原理#(3)非理想的二组分液态混合物(4)部分互溶的双液系(5)不互溶的双液系-蒸汽蒸馏杠杆规则下边的图形为理想的完全互溶双液系的T一x图设:在一个完全互溶的双液系中,组分A的浓度Tas为xA,相对应的温度为T(随组成而变),体系以气液两相共存,液相的浓为x1,气相的浓度为x2,C29体系中两组分A,B的总的物质的量为"总,它为气相的物质的量ng与液相的物质的量n之和IBBnx=n,x,+ngx2则Tnxa+ngx=nx+ngx2X1x/X2A>XABn,(x-x)=n,(x -x)n,-CD=n,CE或这个规则称为杠杆规则,适用于任何两相平衡的计算,对任何浓度单位也都适用。蒸馏(或精馏)的基本原理1.用相图说明双液系在封闭的容器中发生气液相变时的变化规律2.用相图说明在蒸馏过程中的变化情况。3.精馏原理
主要教学内容(注明:* 重点 # 难点 ): §5.5 二组分系统的相图及其应用(未完) (1)杠杆规则 (2)蒸馏的基本原理 #(3)非理想的二组分液态混合物 (4)部分互溶的双液系 (5)不互溶的双液系-蒸汽蒸馏 杠杆规则 下边的图形为理想的完全互溶双液系的T —x图 设:在一个完全互溶的双液系中,组分 A 的浓度 为 xA, 相对应的温度为 T(随组成而变),体系以 气液两相共存,液相的浓为x1,气相的浓度为x2, 体系中两组分 A, B 的总的物质的量为 ,它 为气相的物质的量 ng 与液相的物质的量 nl 之和 则 或 这个规则称为杠杆规则,适用于任何两相平衡的计算,对任何浓度单位也都适用。 蒸馏(或精馏)的基本原理 1. 用相图说明双液系在封闭的容器中发生气液相变时的变化规律 2. 用相图说明在蒸馏过程中的变化情况。 3. 精馏原理。 总 n 1 2 n x n x n x 总 = l + g 1 1 2 n x n x n x n x l A + g A = + g n (x x ) n (x x) l − 1 = g 2 − nl CD = ngCE
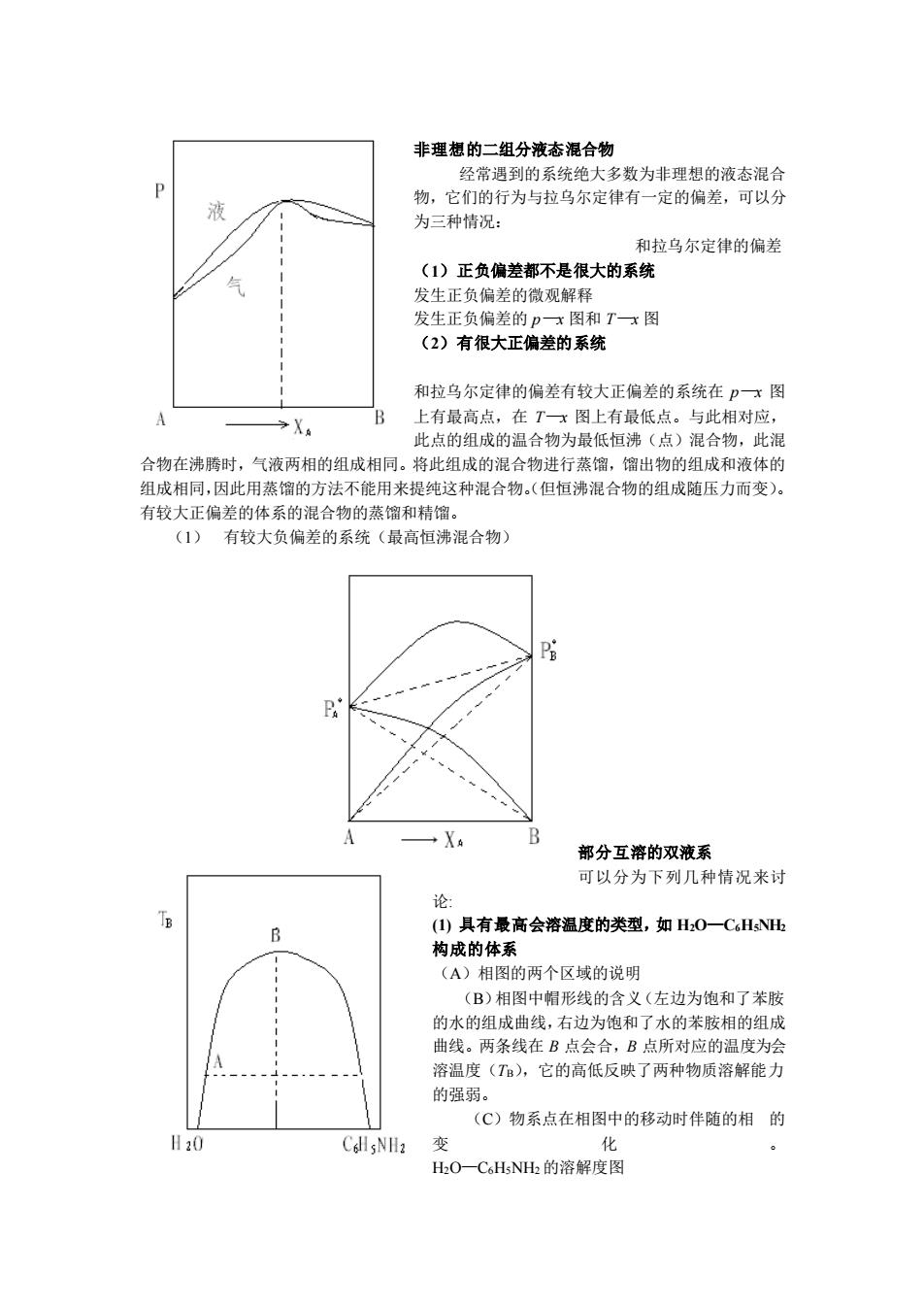
非理想的二组分液态混合物经常遇到的系统绝大多数为非理想的液态混合P物,它们的行为与拉乌尔定律有一定的偏差,可以分为三种情况:和拉乌尔定律的偏差(1)正负偏差都不是很大的系统发生正负偏差的微观解释发生正负偏差的p—x图和T—x图(2)有很大正偏差的系统和拉乌尔定律的偏差有较大正偏差的系统在P一x图上有最高点,在T一x图上有最低点。与此相对应,AB>X此点的组成的温合物为最低恒沸(点)混合物,此混合物在沸腾时,气液两相的组成相同。将此组成的混合物进行蒸馏,馏出物的组成和液体的组成相同,因此用蒸馏的方法不能用来提纯这种混合物。(但恒沸混合物的组成随压力而变)。有较大正偏差的体系的混合物的蒸馏和精馏。(1)有较大负偏差的系统(最高恒沸混合物)PEPABA+XA部分互溶的双液系可以分为下列几种情况来讨论:TE(1)具有最高会溶温度的类型,如H20一CeHsNHzB构成的体系(A)相图的两个区域的说明(B)相图中帽形线的含义(左边为饱和了苯胺的水的组成曲线,右边为饱和了水的苯胺相的组成曲线。两条线在B点会合,B点所对应的温度为会溶温度(TB),它的高低反映了两种物质溶解能力的强弱。(C)物系点在相图中的移动时伴随的相的H20化变ColsNH2H2O—CHsNH2的溶解度图
非理想的二组分液态混合物 经常遇到的系统绝大多数为非理想的液态混合 物,它们的行为与拉乌尔定律有一定的偏差,可以分 为三种情况: 和拉乌尔定律的偏差 (1)正负偏差都不是很大的系统 发生正负偏差的微观解释 发生正负偏差的 p—x 图和 T—x 图 (2)有很大正偏差的系统 和拉乌尔定律的偏差有较大正偏差的系统在 p—x 图 上有最高点,在 T—x 图上有最低点。与此相对应, 此点的组成的温合物为最低恒沸(点)混合物,此混 合物在沸腾时,气液两相的组成相同。将此组成的混合物进行蒸馏,馏出物的组成和液体的 组成相同,因此用蒸馏的方法不能用来提纯这种混合物。(但恒沸混合物的组成随压力而变)。 有较大正偏差的体系的混合物的蒸馏和精馏。 (1) 有较大负偏差的系统(最高恒沸混合物) 部分互溶的双液系 可以分为下列几种情况来讨 论: (1) 具有最高会溶温度的类型,如 H2O—C6H5NH2 构成的体系 (A)相图的两个区域的说明 (B)相图中帽形线的含义(左边为饱和了苯胺 的水的组成曲线,右边为饱和了水的苯胺相的组成 曲线。两条线在 B 点会合,B 点所对应的温度为会 溶温度(TB),它的高低反映了两种物质溶解能力 的强弱。 (C)物系点在相图中的移动时伴随的相 的 变 化 。 H2O—C6H5NH2 的溶解度图

(2)具有最低会溶温度的类型,如水与三乙基胺的双液系属于此种类型。(3)同时具有最高及最低会溶温度的类型。H2O—C6HsNH2的溶解度图(4)不具有会溶温度的类型的相图。例:物理化学简明教程(印永嘉编)P216例6完全不互溶的双液系一蒸气蒸馏如果两种液体的彼此的溶解度非常小,以致可以忽略不计,则可看作是彼此是不溶的。完全不溶的双液系的特点:两种不互溶的液体共存时,各组分的蒸气压与它们单独存在时相同,而混合液面上总的蒸气压为两组分的蒸气压之和,P=PA+PB。且混合物系的沸点低于任一组分单独存在时的沸点(以水+溴苯为例说明之)。应用:完全不互溶的双液系的这种性质常用于水蒸汽蒸馏,在馅出物中A,B两组分的质量可以求出如下:naPA=px=p-na+ngngPB = px = p-na+ngPi-nB-Wg/MgPnAWAIMA两式相除Wa=PaMeWPMA即在一般的情况下,虽然有机物的蒸气压P要比水的蒸气压PA小得多,但因MB>MA,所以水蒸气带出的有机物的量不会太小
(2) 具有最低会溶温度的类型,如水与三乙 基胺的双液系属于此种类型。 (3) 同时具有最高及最低会溶温度的类型。 H2O—C6H5NH2 的溶解度图 (4) 不具有会溶温度的类型的相图。例:物理化学简明教程(印永嘉编)P216 例 6 完全不互溶的双液系—蒸气蒸馏 如果两种液体的彼此的溶解度非常小,以致可以忽略不计,则可看作是彼此是不溶的。 完全不溶的双液系的特点:两种不互溶的液体共存时,各组分的蒸气压与它们单独存在时相 同,而混合液面上总的蒸气压为两组分的蒸气压之和,P = P* A + P* B。且混合物系的沸点低于 任一组分单独存在时的沸点(以水+溴苯为例说明之)。 应用:完全不互溶的双液系的这种性质常用于水蒸汽蒸馏,在馏出物中 A,B 两组分的质量 可以求出如下: 两式相除 即 在一般的情况下,虽然有机物的蒸气压 P * B要比水的蒸气压 P * A小得多,但因 MB >MA,所 以水蒸气带出的有机物的量不会太小。 A B g B B B A B g A A A n n n p px p n n n p px p + = = + = = A A B B A B A B W M W M n n p p / / = = A B A B A B M M p p W W =