
(三)ATP合成机理 Boyer 结合变化模型(Binding change model)
(三)ATP合成机理 Boyer : 结合变化模型(Binding change model)
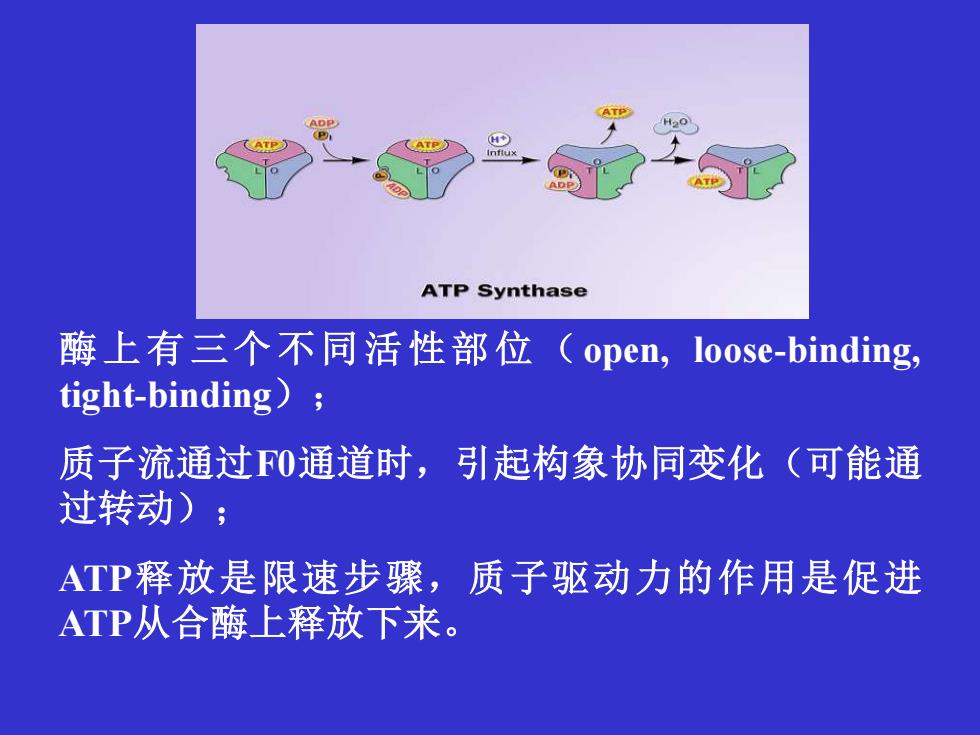
ATP Synthase 酶上有三个不同活性部位(open,loose-binding tight-binding) 质子流通过0通道时,引起构象协同变化(可能通 过转动); ATP释放是限速步骤,质子驱动力的作用是促进 ATP从合酶上释放下来
酶上有三个不同活性部位 (open, loose-binding, tight-binding); 质子流通过F0通道时,引起构象协同变化(可能通 过转动); ATP释放是限速步骤,质子驱动力的作用是促进 ATP从合酶上释放下来

The Nobel Prize in Chemistry 1997 Press release 机制和旋转催化 合成酶的结合变化 "for their elucidation of the enzymatic mechanism underlying the synthesis of adenosine triphosphate (ATP)" Paul D.Boyer John E.Walker USA U.K. University of Medical Research California, Council Los Angeles,USA Laboratory of Molecular Biology, Cambridge,U.K. 1918 1941- Autobiography Nobel Diploma Autobiography Prize Award Nobel Diploma Ceremony Prize Award Ceremony
ATP 合成酶的结合变化 机制和旋转催化
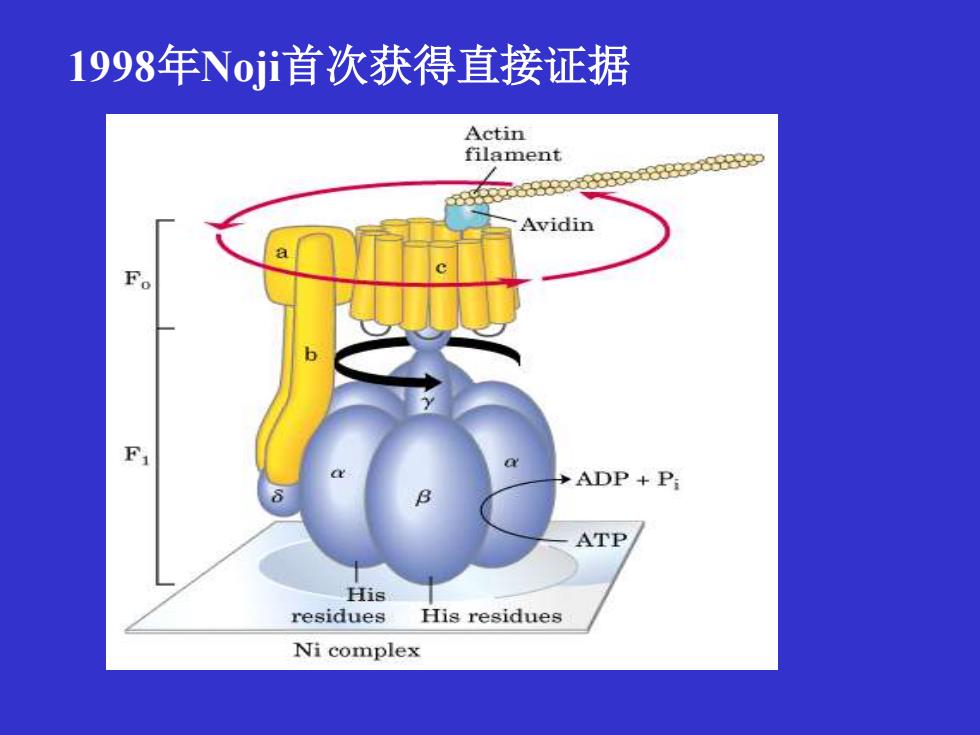
1998年Noii首次获得直接证据 Actin 8888208380888y filament Avidin Fo F >ADP+Pi ATP His residues His residues Ni complex
1998年Noji首次获得直接证据

F一ATP酶为旋转马达,旋转步幅为120度, 每旋转120度大约做功80pNnm。 旋转马达对能量转换的高效率,是迄今所发现 的其它马达蛋白无法比拟的!?
F1-ATP酶为旋转马达,旋转步幅为120度, 每旋转120度大约做功80 pN nm。 旋转马达对能量转换的高效率,是迄今所发现 的其它马达蛋白无法比拟的!?