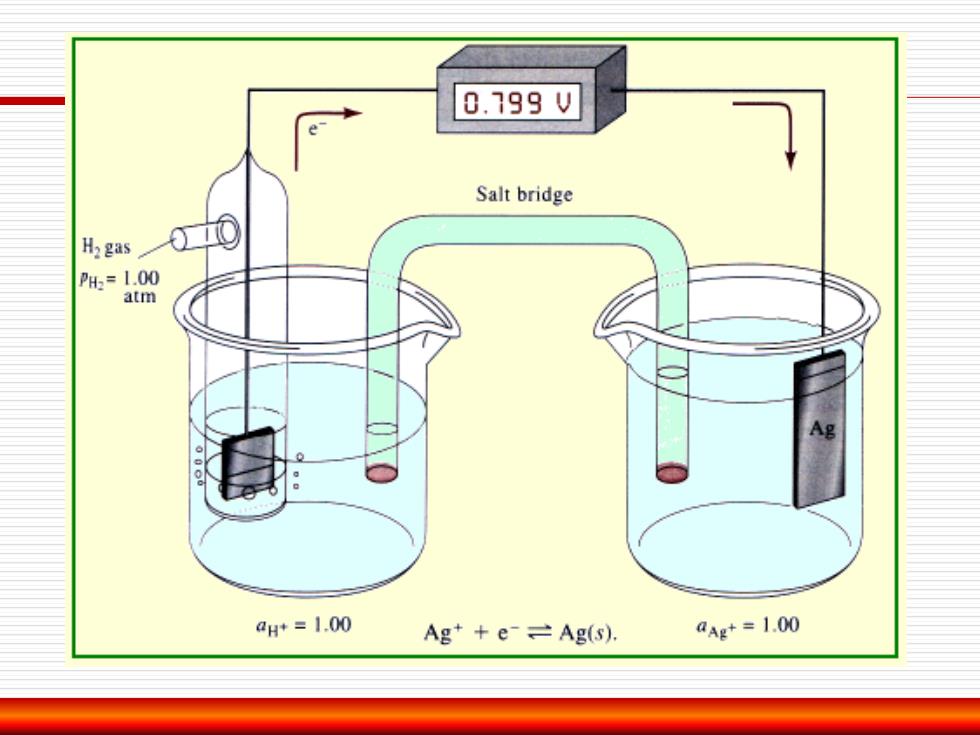
0.799V Salt bridge 品s00 PH:=1.00 atm aH*=1.00 Ag e Ag(s). aAg+=1.00

标准电极电位 规定:将标准氢电极作为负极与待测电极组成电池,电位差 (电池电动势)即该电极的相对电极电位,比标准氢电极的电 极电位高的为正,反之为负; 在298.15K时,以水为溶剂,当氧化态和还原态的活度等 于1时的电极电位称为:标准电极电位。 PtH,(101 325 Pa ),H+(1mol/dm)Ag"(1mol/dm3)Ag 电位差:+0.799V写 银电极的标准电极电位:+0.799V
规定:将标准氢电极作为负极与待测电极组成电池,电位差 (电池电动势)即该电极的相对电极电位,比标准氢电极的电 极电位高的为正,反之为负; 在298.15 K 时,以水为溶剂,当氧化态和还原态的活度等 于1 时的电极电位称为:标准电极电位。 Pt|H2 (101 325 Pa ),H+ (1mol/dm)||Ag+ (1mol/dm3 )|Ag 电位差:+0.799 V; 银电极的标准电极电位:+0.799 V。 标准电极电位

Standard Electrode Potentials Reaction EO at 25C,V Cl(8)+2e-=2CI- +1.359 0(8)+4H++4e-=2H2O +1.229 Bra(ag)+2e-2Br +1.087 Br2()2e-=2Br- +1.065 Ag +e-=Ag(s) +0.799 Fe3++e-=Fe2+ +0.771 5+2e=3I +0.536 Cu2+2e-=Cu(s) +0.337 U0g++4H++2e-+=U4++2H20 +0.334 Hg2Cl2(s)+2e-=2Hg(l)+2CI- +0.268 AgCl(s)+eAg(s)+Cl- +0.222 AgS203)月+e-=Ag(s)+2S203 +0.017 2H+2e=H(g) 0.000 Agl(s)e-=Ag(s)+I- -0.151 PbSOa(s)2e-=Pb(s)+SO- -0.350 Cd2+2e-=Cd(s) -0.403 Zn2+2e-Zn(s) -0.763

三、电位法基本原理 Nernst)方程 对于任一电极反应: O.+ne→Red 电极电位为 p=0+ RT In do nF aR 其中,为标准电极电位;R为摩尔气体常数 83145J/mol-K);T为绝对温度;F为Faraday常数 (96485Cmo;n为电子转移数;a为活度
对于任一电极反应: 电极电位为: 其中,0为标准电极电位;R为摩尔气体常数 (8.3145J/molK); T为绝对温度;F为Faraday常数 (96485C/mol);n为电子转移数;a为活度。 三、电位法基本原理——Nernst方程 Ox ne Re d ln O R RT a nF a

Nernst方程 在常温下,Nernst,方程为: 0=0°1 0.059 ao n lo ar 上述方程式称为电极反应的Nernst方程 电位分析法的关键是如何准确测定电极电位值
在常温下,Nernst方程为: 上述方程式称为电极反应的 Nernst 方程 R O a a n log 0 0.059 电位分析法的关键是如何准确测定电极电位值。 Nernst 方程