
一、化学电池Electrochemical cell 由一对电极、电解质和外电路三部分组成。 原电池(primary cell,Galvanic or voltaic cell)三 自发的将电池内部进行的化学反应所产生的能量转化成 电能的化学电池。 电解池(electrolytic cell): 实现电化学反应的能量由外电源供给的化学电池,将电 能转变为化学能。 溶液中的电流:正、负离子的移动
由一对电极、电解质和外电路三部分组成。 原电池(primary cell ,Galvanic or voltaic cell ): 自发的将电池内部进行的化学反应所产生的能量转化成 电能的化学电池。 电解池(electrolytic cell): 实现电化学反应的能量由外电源供给的化学电池,将电 能转变为化学能。 溶液中的电流:正、负离子的移动。 一、化学电池 Electrochemical cell

电池表达式 (白)电极a溶液(a‖溶液(a,电极b(⊕) 阳极 阴极 (-Zn ZnSO(a)Cuso(a2)Cu (+ 以」表示金属和溶液的两相界面,以‖表示 盐桥。习惯将阳极写在左边,阴极写在右边。 电池电动势:E=p。·p十P液接=P右P左+P液接 当E>O,自发进行电池反应,为原电池; 当E<0非自发进行电池反应,为电解池
电池表达式 (-) 电极a 溶液(a1 ) 溶液(a2 ) 电极b (+) 阳极 E 阴极 (-) Zn│ZnSO4(ɑ1)‖CuSO4(ɑ2)│Cu(+) 以 表示金属和溶液的两相界面,以 表示 盐桥。习惯将阳极写在左边,阴极写在右边。 电池电动势: E = c - a +液接 = 右 - 左+液接 当E>0,自发进行电池反应, 为原电池; 当E<0 非自发进行电池反应, 为电解池

二、电极电位electrode potential 1、电极电位的产生: 金属晶体是由金属离子和自由电子所构成。 将金属M插入含有该金属离子的溶液中时,金属离子有从 金属相进入溶液相的趋势,金属相留下过剩的电子,它们 与进入溶液的金属离子在金属表面形成双电层; 金属离子也有从溶液相进入金属相的趋势,溶液中留下过 剩的阴离子,它们与进入金属相的金属离子在金属表面形 成双电层
二、电极电位 electrode potential 1、电极电位的产生: 金属晶体是由金属离子和自由电子所构成。 将金属M插入含有该金属离子的溶液中时,金属离子有从 金属相进入溶液相的趋势,金属相留下过剩的电子,它们 与进入溶液的金属离子在金属表面形成双电层; 金属离子也有从溶液相进入金属相的趋势,溶液中留下过 剩的阴离子,它们与进入金属相的金属离子在金属表面形 成双电层

电极电位 双电层的形成,使两相界面处出现电位差。当金属离 子进出溶液的速度相等时,金属相与溶液相之间建立 起动态平衡,达到一个稳定的电位差值,叫做相界电 位 电极电位
双电层的形成,使两相界面处出现电位差。当金属离 子进出溶液的速度相等时,金属相与溶液相之间建立 起动态平衡,达到一个稳定的电位差值,叫做相界电 位 —— 电极电位。 电极电位
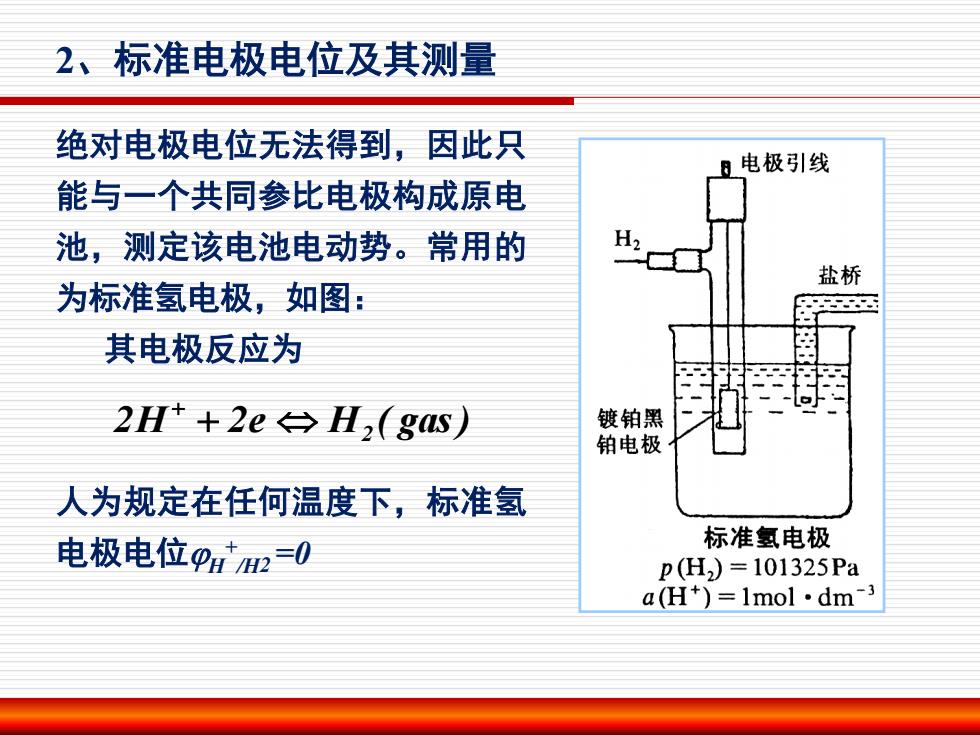
2、标准电极电位及其测量 绝对电极电位无法得到,因此只 日电极引线 能与一个共同参比电极构成原电 池,测定该电池电动势。常用的 H2 盐桥 为标准氢电极,如图: 其电极反应为 2H++2e→H,(gs) 镀铂黑 铂电极 人为规定在任何温度下,标准氢 电极电位pa2=0 标准氢电极 p(H2)=101325Pa a(H+)=1mol·dm-3
绝对电极电位无法得到,因此只 能与一个共同参比电极构成原电 池,测定该电池电动势。常用的 为标准氢电极,如图: 其电极反应为 人为规定在任何温度下,标准氢 电极电位H + /H2 =0 2H 2e H ( gas) 2 2、标准电极电位及其测量