
影响电导率的因素 电解质溶液电导率大小主要取决于两方面: 1.离子的多少; 2.离子的运动速度。 外界条件的影响: a.温度温度越高,离子的运动速度越大,电导率越大: b.溶剂粘度溶剂粘度越大,v越小,电导率越小 离子本性: a.水化离子半径r 半径越大,则v越小,电导率越小 b.离子价数 离子价数越大,则越大,电导率越大 c.特殊迁移方式 H+、OH~是一般离子导电能力5-8倍 电解质溶液浓度: 浓度增加时,一方面,离子数增加;另一方面,由于弛豫效 应、电泳效应,离子运动速度减小;
影响电导率的因素 电解质溶液电导率大小主要取决于两方面: 1. 离子的多少; 2. 离子的运动速度。 外界条件的影响: a. 温度 温度越高,离子的运动速度v越大,电导率越大; b. 溶剂粘度 溶剂粘度越大,v越小,电导率越小 离子本性: a. 水化离子半径r 半径r越大,则v越小,电导率越小 b. 离子价数 离子价数越大,则v越大,电导率越大 c. 特殊迁移方式 H+ 、OH-是一般离子导电能力5-8倍 电解质溶液浓度: 浓度增加时,一方面,离子数增加;另一方面,由于弛豫效 应、电泳效应,离子运动速度减小;

电导率与浓度的关系 强电解质溶液的电导率随着浓度的增加,首先是增加, 达到某一极大值,然后随浓度的增加反而下降。这是由 于开始浓度增加时导电粒子数目增多故电导率增加,当 浓度增加到一定程度以后,离子间的相互作用增强,使 离子运动速度降低,其电导率反而下降。 弱电解质溶液电导率随浓度变化不明显,因浓度增加使 其电离度减小,溶液中真正起导电作用的粒子数目变化 不大。 中性盐由于受饱和溶解度的限制,浓度不能太高,如 KCl
电导率与浓度的关系 强电解质溶液的电导率随着浓度的增加,首先是增加, 达到某一极大值,然后随浓度的增加反而下降。这是由 于开始浓度增加时导电粒子数目增多故电导率增加,当 浓度增加到一定程度以后,离子间的相互作用增强,使 离子运动速度降低,其电导率反而下降。 弱电解质溶液电导率随浓度变化不明显,因浓度增加使 其电离度减小,溶液中真正起导电作用的粒子数目变化 不大。 中性盐由于受饱和溶解度的限制,浓度不能太高,如 KCl
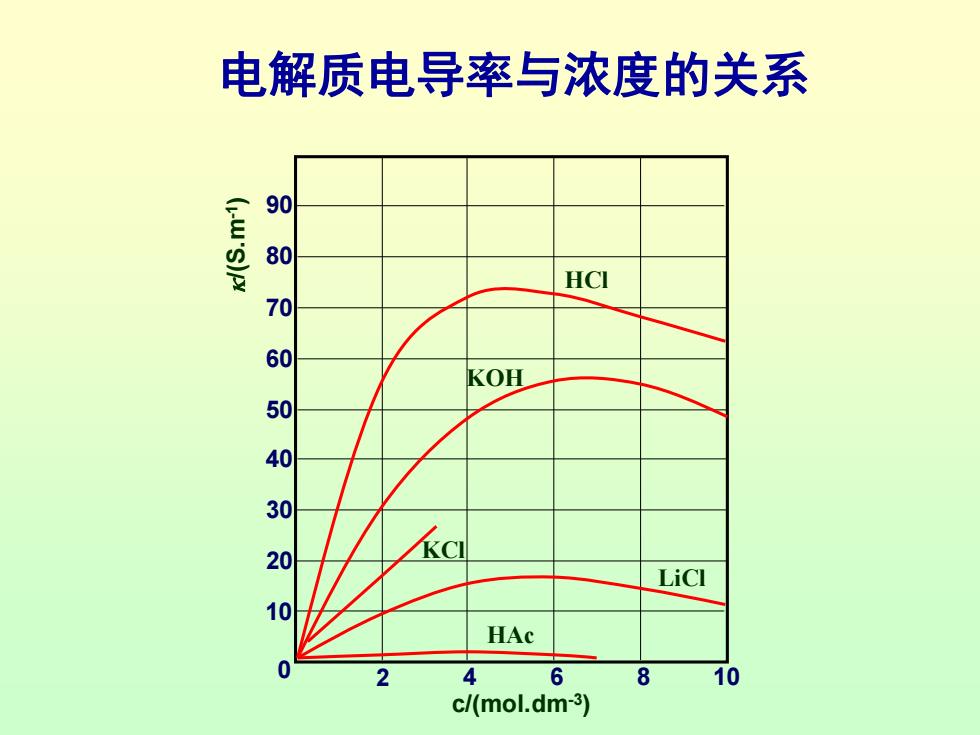
电解质电导率与浓度的关系 007605040010 HCI KOH LiCl HAc 4 6 10 c/(mol.dm-3)
2 0 4 6 8 10 10 20 30 40 50 60 70 80 90 c/(mol.dm-3 ) /(S.m-1 ) HAc LiCl KCl KOH HCl 电解质电导率与浓度的关系

摩尔电导率与浓度的关系 由于溶液中物质的量已给定,都为 1mol。当浓度变化时,溶液的摩尔电导 率的变化与以下两种因素有关。 ①导电离子数目的变化 ②离子间的作用力的变化 不同的电解质,其摩尔电导率随浓 度变化的规律也不相同
摩尔电导率与浓度的关系 由于溶液中物质的量已给定,都为 1mol。当浓度变化时,溶液的摩尔电导 率的变化与以下两种因素有关。 ①导电离子数目的变化 ②离子间的作用力的变化 不同的电解质,其摩尔电导率随浓 度变化的规律也不相同
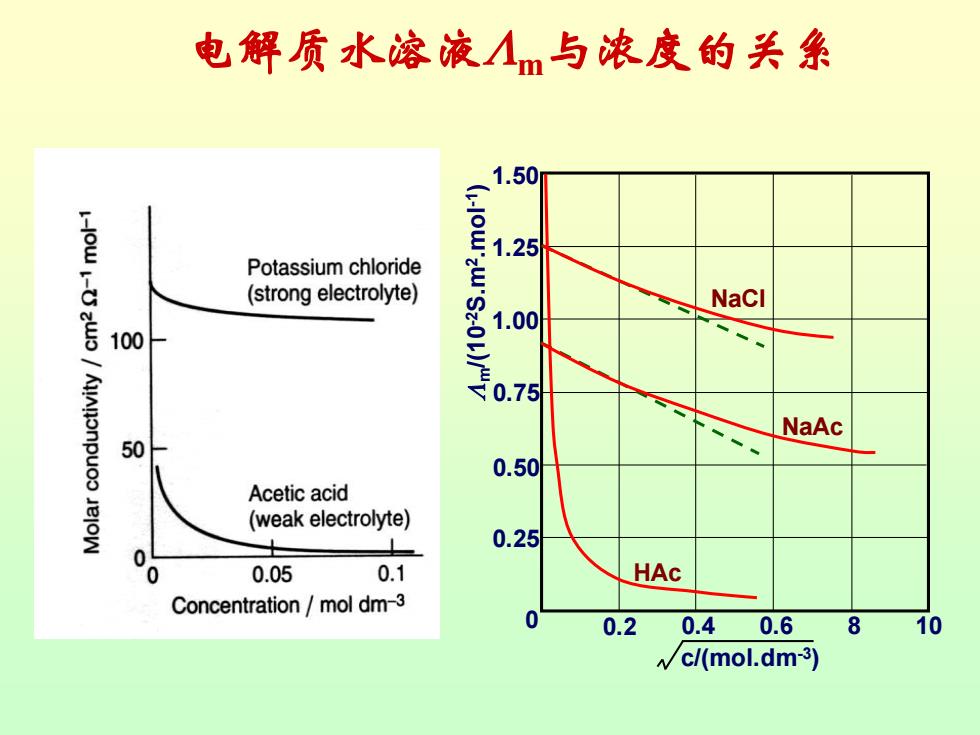
电解质水溶液与浓度的关系 1.50 1.25 Potassium chloride (strong electrolyte) NaCI 100 AjAnonpuoo NaAc 50 0.50 Acetic acid (weak electrolyte) 0.25 0.05 0.1 HAc Concentration mol dm-3 0.2 0.4 0.6 8 10 c/(mol.dm-3)
电解质水溶液m与浓度的关系 0.2 0 0.4 0.6 8 10 c/(mol.dm-3 ) 0.25 0.50 0.75 1.00 1.25 1.50 m/(10 -2S.m 2.mol -1 ) NaCl NaAc HAc