
电位分析的依据是能斯特关系。 若电极的氧化还原体系为: Ox ne-=Red RT In nF aRed 比如:对于金属电极:M|M+(还原态为金属,活度定为1) 则 nF 建立的测量化学电池(原电池):MIM+参比电极 那么 E=中,一中+血(液接电位) =参比一指示 =s比-8NM一nF
电位分析的依据是能斯特关系。 若电极的氧化还原体系为: Ox + n e- = Red Re d O Ox Ox/Red ln a a nF RT = + = n+ + Mn+ O M /M ln a nF RT 比如:对于金属电极:M ∣M+ (还原态为金属,活度定为1) 建立的测量化学电池(原电池):M ∣M+‖参比电极 = − + − + = − = + − − + n M n O M / M ln a nF RT E L 参 比 参 比 指 示 (液接电位) 则 那么
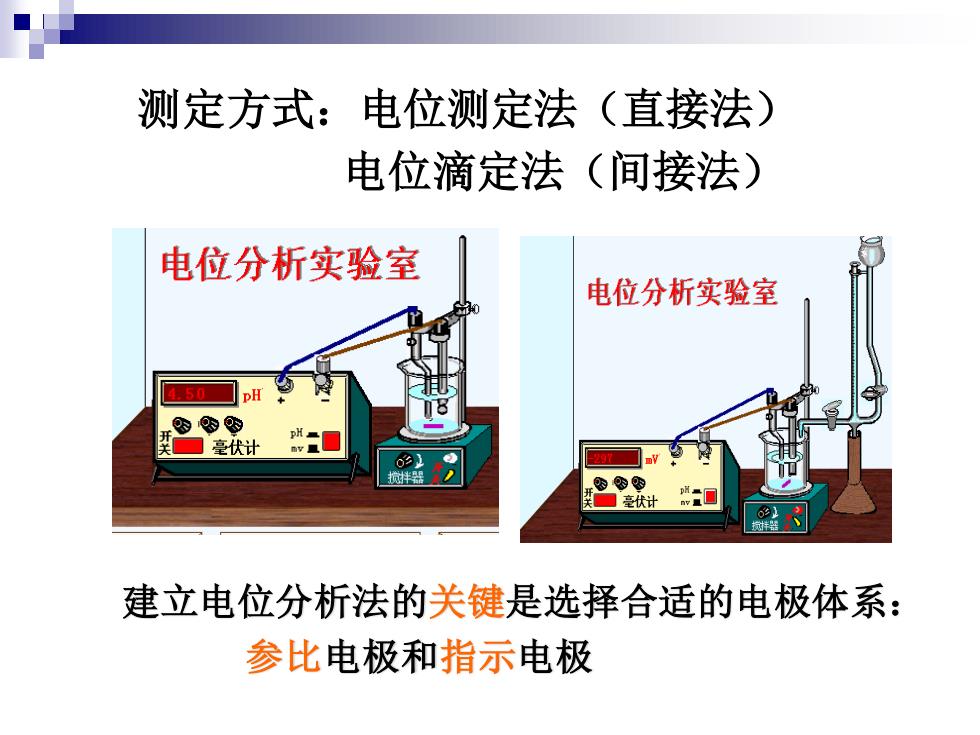
测定方式:电位测定法(直接法) 电位滴定法(间接法) 电位分析实验室 电位分析实验室 5☐pH 08 毫计 建立电位分析法的关键是选择合适的电极体系: 参比电极和指示电极
测定方式:电位测定法(直接法) 电位滴定法(间接法) 建立电位分析法的关键是选择合适的电极体系: 参比电极和指示电极

第2节 参比电极 1.标准氢电极 2.甘汞电极 3.银-氯化银电极
1.标准氢电极 2.甘汞电极 3.银-氯化银电极 第2节 参比电极

参比电极是测量电池电动势,计算电极电位的 基准,因此要求它的电极电位已知而且恒定。 性能要求:参比电极在测量过程中,即使有微 小电流通过,仍能保持不变;它与不同的测试溶液 间的液体接界电位差异很小,数值很低,可以忽略 不计;容易制作,使用寿命长。 重要的参比电极有标准氢电极、甘汞电极、银 -氯化银电极等。其中,标准氢电极是电极电位的 一级基准,甘汞电极、银-氯化银等金属及其难溶 盐的电极作为二级基准,是常用的参比电极
参比电极是测量电池电动势,计算电极电位的 基准,因此要求它的电极电位已知而且恒定。 性能要求:参比电极在测量过程中,即使有微 小电流通过,仍能保持不变;它与不同的测试溶液 间的液体接界电位差异很小,数值很低,可以忽略 不计;容易制作,使用寿命长。 重要的参比电极有标准氢电极、甘汞电极、银 -氯化银电极等。其中,标准氢电极是电极电位的 一级基准,甘汞电极、银-氯化银等金属及其难溶 盐的电极作为二级基准,是常用的参比电极

1.标准氢电极 (standard hydrogen electrode,简写SHE) 把镀有铂黑的铂片浸入a+=1的溶液中,并以p的纯净氢 气不断地冲击到铂片上,即构成了标准氢电极(见图)。 电极符号:H+(a=1)H2(p8),P* 电极反应为: 2Ht+2e→ 1953年,IUPAC规定标准氢电极的电 极电势在任何温度下恒为零,作为电极 标准氢电极 电势的一级基准(如同海拔高度以海平 面作基准一样)。 但直接用SHE作参比很不方便
1.标准氢电极 (standard hydrogen electrode ,简写SHE) 把镀有铂黑的铂片浸入aH+ =1的溶液中,并以pθ的纯净氢 气不断地冲击到铂片上,即构成了标准氢电极(见图)。 电极符号:H+( aH+=1 )|H2(pθ),Pt 电极反应为: 2H++2e→H2 1953年,IUPAC规定标准氢电极的电 极电势在任何温度下恒为零,作为电极 电势的一级基准(如同海拔高度以海平 面作基准一样)。 但直接用SHE作参比很不方便