
3.Hess定律 反应一步完成的热效应等于分步进行的各步热效 应之和。 反应的热效应只与始终态有关,与变化途径无关。 小结: •条件相同的反应或聚集状态相同的同种物质才能 相消或合并。 •反应式乘(或除)以某数,相应的热效应也要同 乘(除)以该数
3.Hess定律 反应一步完成的热效应等于分步进行的各步热效 应之和。 反应的热效应只与始终态有关,与变化途径无关。 小结: •条件相同的反应或聚集状态相同的同种物质才能 相消或合并。 •反应式乘(或除)以某数,相应的热效应也要同 乘(除)以该数

4、热化学方程式((△H°表示反应热) 思考: ①中学的热化学方程式与用△H°表示的热化学方 程式有何差异? ②△H°的单位为KJ/mol,mol-1表示什么? ③对同一反应,反应是书写不同,△H值有无变化? ④°代表是么? 5、标准态物质状态的参比基准线 规定:标准压强下物质的确切聚集状态。 [注]对温度没有规定。 [比较]气体标准状态
4、热化学方程式(△H⊙表示反应热) 思考: ①中学的热化学方程式与用△H⊙表示的热化学方 程式有何差异? ②△H⊙的单位为KJ/mol,mol-1表示什么? ③ 对同一反应,反应是书写不同,△H⊙值有无变化? ④⊙代表是么? 5、标准态——物质状态的参比基准线 规定:标准压强下物质的确切聚集状态。 [注] 对温度没有规定。 [比较] 气体标准状态

说明: ①、气体的标准态:Po=1.013×105 ②、 溶液中溶质的标准态:标准压强下,溶质的 浓度为1mol/L,即Co=lmol/L ③、液体和固体的标准态:Po下的纯物质。 6、反应热的计算 ①、原侧—Hess定律 [问题]能否通过较少的实验数据获得任意化学反 应的热效应? [分析]反应A+B→C+D △HO=H⊙产物-H°反应物 绝对法难确定△H©,可用相对法解决
说明: ①、气体的标准态:P⊙ = 1.013×105 ②、溶液中溶质的标准态:标准压强下,溶质的 浓度为 1mol/L, 即 C⊙ =1mol/L ③、液体和固体的标准态: P⊙下的纯物质。 6、反应热的计算 ①、原则——Hess定律 [问题] 能否通过较少的实验数据获得任意化学反 应的热效应? [分析] 反应 A + B C + D △H⊙ = H ⊙ 产物 - H ⊙ 反应物 绝对法难确定△H⊙ ,可用相对法解决

②、标准生成焓 定义:温度T、标态时,由指定单质生成1mol某 物质(以化学式表示)的焓变。 [说明] 指定单质:多为元素的最稳定单质,状态亦指定。 生成反应:指定单质反应生成1mol生成物的过程。 [推论]:指定单质△Hm°=0 △HmO非绝对值 熟悉元素的指定单质、物质的生成过程。 H,Na,K,C,O,N,F,Cl,Br,I 写出生成过程:CO2,MgO,KBr,NaI
②、标准生成焓——△fHm ⊙ 定义:温度T、标态时,由指定单质生成1mol某 物质(以化学式表示)的焓变。 [说明] 指定单质:多为元素的最稳定单质,状态亦指定。 生成反应:指定单质反应生成1mol生成物的过程。 [推论]: 指定单质△fHm ⊙ =0 △fHm ⊙非绝对值 熟悉元素的指定单质、物质的生成过程。 H, Na, K, C, O, N, F, Cl, Br, I 写出生成过程:CO2 , MgO, KBr, NaI
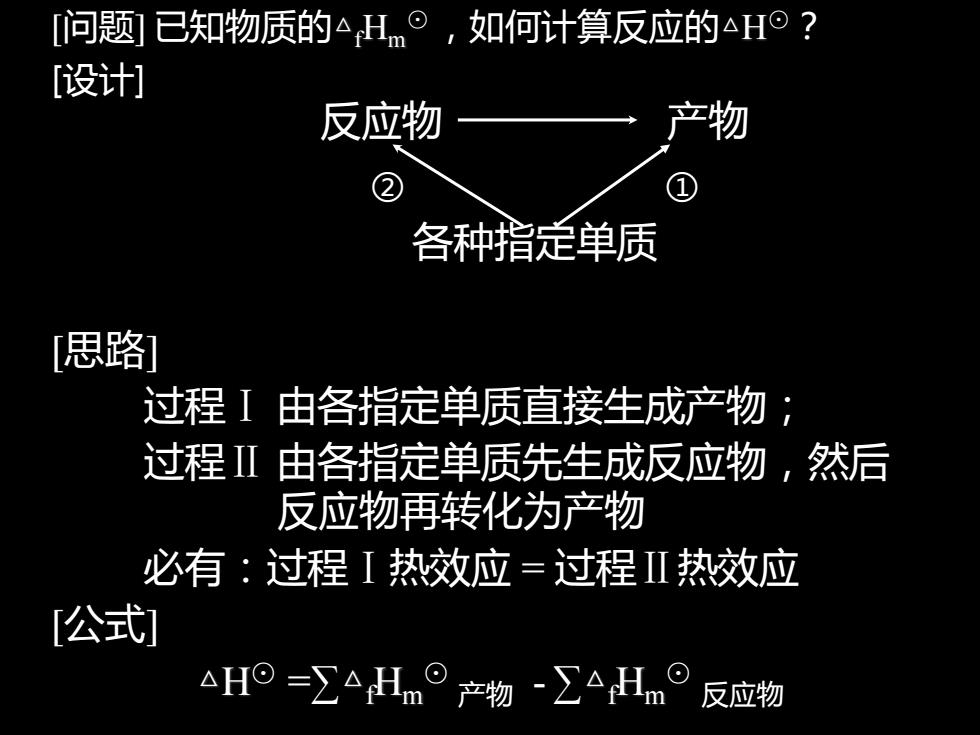
[问题]已知物质的△Hm。,如何计算反应的△H°? [设计] 反应物 各种指定单质 [思路 过程I由各指定单质直接生成产物: 过程Ⅱ由各指定单质先生成反应物,然后 反应物再转化为产物 必有:过程I热效应=过程Ⅱ热效应 [公式] △H=∑△Hm°产物-∑△Hm° 反应物
[问题] 已知物质的△fHm ⊙ ,如何计算反应的△H⊙? [设计] 反应物 产物 ② ① 各种指定单质 [思路] 过程Ⅰ 由各指定单质直接生成产物; 过程Ⅱ 由各指定单质先生成反应物,然后 反应物再转化为产物 必有:过程Ⅰ热效应 = 过程Ⅱ热效应 [公式] △H⊙ =∑△fHm ⊙ 产物 - ∑△fHm ⊙ 反应物