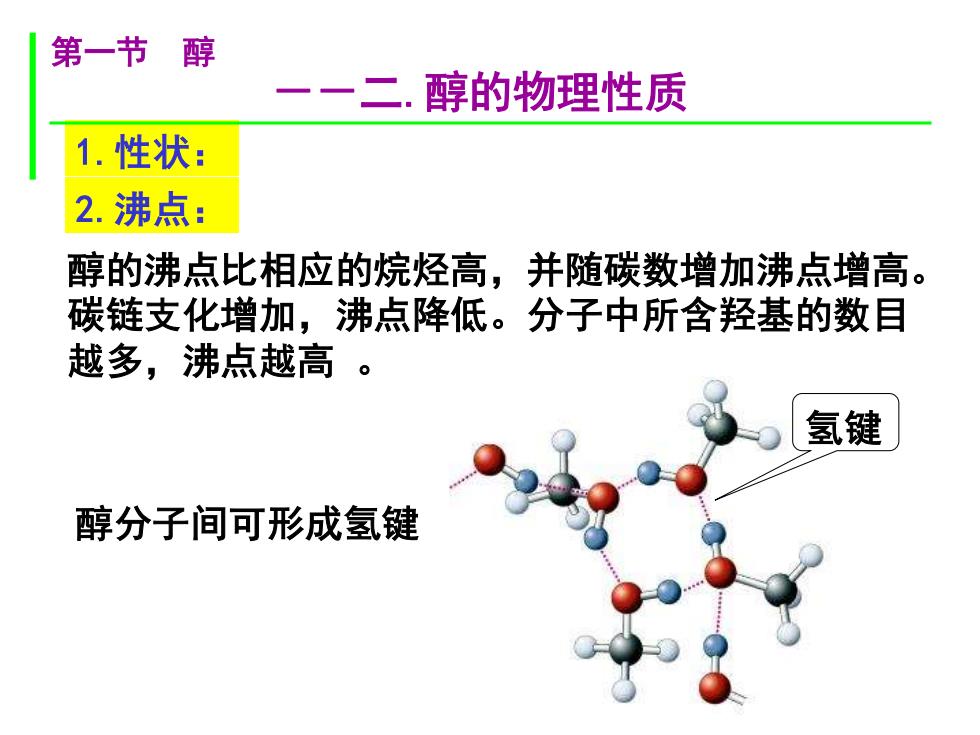
第一节醇 一二.醇的物理性质 1.性状: 2.沸点: 醇的沸点比相应的烷烃高,并随碳数增加沸点增高。 碳链支化增加,沸点降低。分子中所含羟基的数目 越多,沸点越高。 氢键 醇分子间可形成氢键
醇的沸点比相应的烷烃高,并随碳数增加沸点增高。 碳链支化增加,沸点降低。分子中所含羟基的数目 越多,沸点越高 。 醇分子间可形成氢键 氢键 1.性状: 2.沸点: 第一节 醇 --二.醇的物理性质

第一节醇 一一二.醇的物理性质 3.溶解度: >甲、乙、丙醇可与水混溶(原因:与水形成氢键); >C4以上则随着碳链增长溶解度减小(烃基增大,其遮 蔽作用增大,阻碍了醇羟基与水形成氢键); >分子中羟基越多,在水中的溶解度越大,沸点越高。 如乙二醇(bp=197℃)、丙三醇(bp=290℃)可与水 混溶
➢ 甲、乙、丙醇可与水混溶(原因:与水形成氢键); ➢ C4以上则随着碳链增长溶解度减小(烃基增大,其遮 蔽作用增大,阻碍了醇羟基与水形成氢键); ➢ 分子中羟基越多,在水中的溶解度越大,沸点越高。 如乙二醇(bp=197℃)、丙三醇(bp=290℃)可与水 混溶。 3.溶解度: 第一节 醇 --二.醇的物理性质
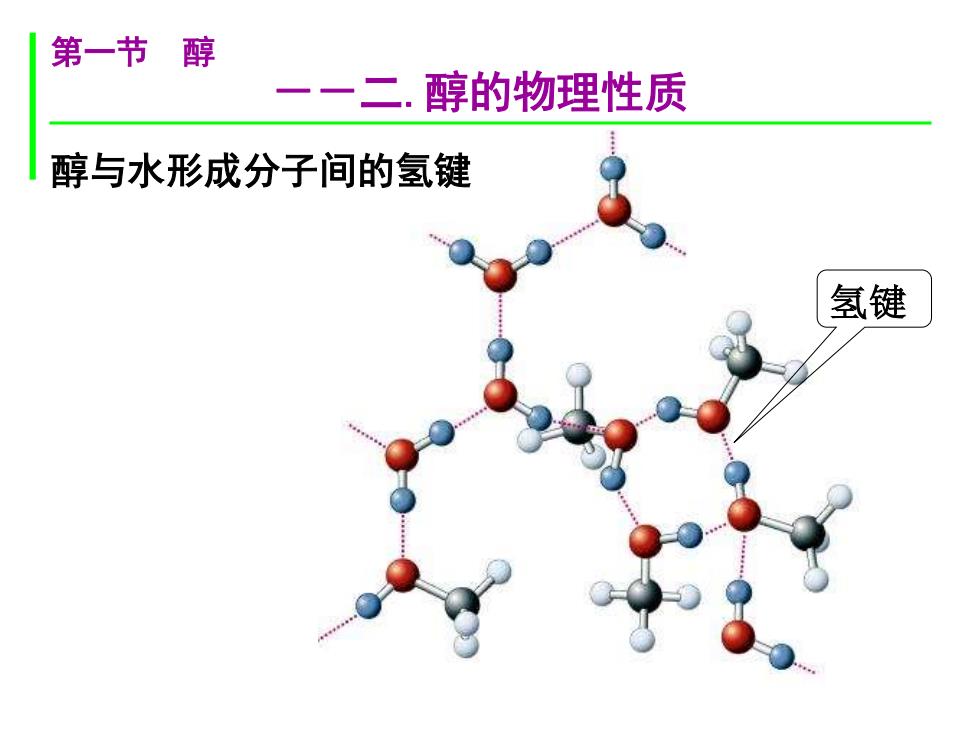
第一节醇 一一二.醇的物理性质 醇与水形成分子间的氢键 氢键
氢键 醇与水形成分子间的氢键 第一节 醇 --二.醇的物理性质

第一节醇 醇的物理性质 4.结晶醇的形成 低级醇能和一些无机盐(MgCl2CaCl2CuS04等) 作用形成结晶醇,亦称醇化物。 如: MgCl2·6CH3OH 不溶于有机溶剂,溶于水。 CaCl2·4C2HOH 结晶醇: CaCl2·4CH3OH 可用于除去有机物中的少量醇
低级醇能和一些无机盐(MgCl2、CaCl2、CuSO4等) 作用形成结晶醇,亦称醇化物。 如: MgCl 2 6CH3 OH CaCl 2 4C2 H5 OH CaCl 2 4CH3 OH 结晶醇: 不溶于有机溶剂,溶于水。 可用于除去有机物中的少量醇 4.结晶醇的形成 第一节 醇 --二.醇的物理性质

第一节醇 三.醇的光谱性质 IR IR中 -OH有两个吸收峰 36403610cm-1 未缔合OH的吸收带,外形较锐。 36003200cm-1 缔合OH的吸收带,外形较宽。 伯醇在1060~1030cm1 C-0的吸收峰在10001200cm-1: 仲醇在1100cm1附近 叔醇在1140cm1附近 NMR NMR中 0一H的核磁共振信号由于受氢键、温度、 溶剂性质等影响,可出现δ值在1~5.5的范围内
IR中 -OH有两个吸收峰 3640~3610cm-1 未缔合OH的吸收带,外形较锐。 3600~3200cm-1 缔合OH的吸收带,外形较宽。 C-O的吸收峰在1000~1200cm-1: IR NMR中 O—H的核磁共振信号由于受氢键、温度、 溶剂性质等影响,可出现δ值在1~5.5的范围内。 NMR 伯醇在1060~1030cm-1 仲醇在1100cm-1附近 叔醇在1140cm-1附近 第一节 醇 --三.醇的光谱性质