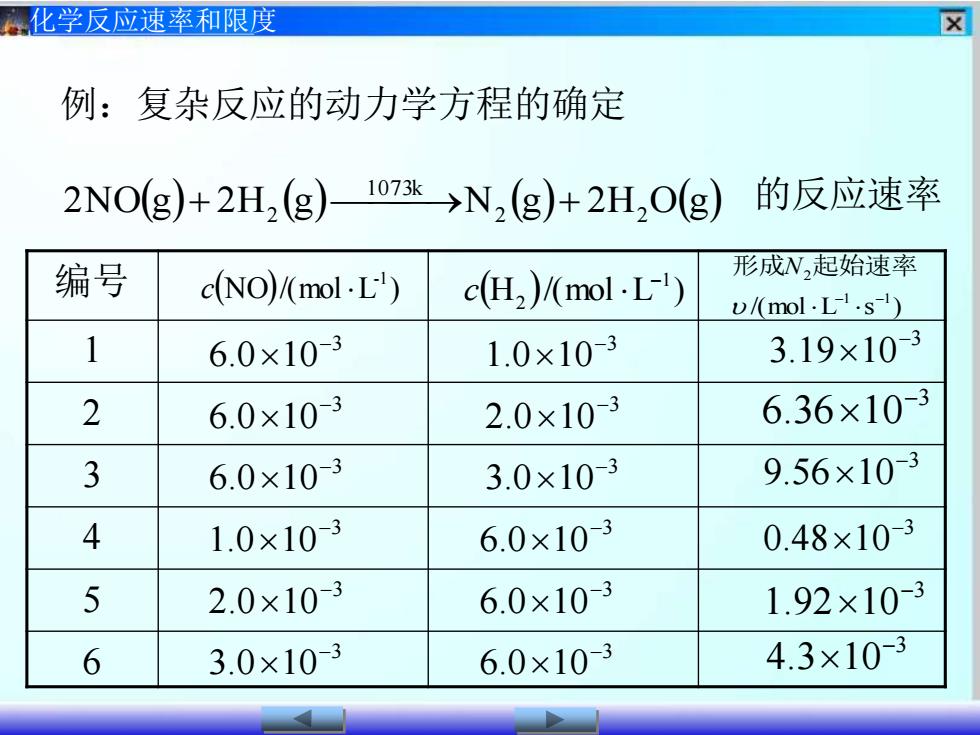
区化学反应速率和限度例:复杂反应的动力学方程的确定1073k的反应速率2NO(g)+ 2H, (g)>N, (g)+ 2H,O(g)形成N,起始速率编号c(NO)/(mol L')c(H,)/(mol L-')u /(mol L-l .s-l)3.19×10-316.0×10-31.0×10-36.36 ×10-326.0×10-32.0×10-39.56x×10-336.0 ×10-33.0×10-341.0×10-30.48×10-36.0×10-352.0×10-36.0×10-31.92×10-34.3×10-63.0×10-36.0×10-3
化学反应速率和限度 2N O(g)+ 2H2 (g)⎯1073 ⎯k →N2 (g)+ 2H2 O(g) 的反应速率 编号 1 2 3 4 5 6 (H )/(mol L ) 1 2 − (NO)/(mol L ) c -1 c /(mol L s ) 1 1 2 − − 形成N 起始速率3 3.19 10− 3 6.36 10− 3 9.56 10− 3 0.48 10− 3 1.92 10− 3 6.0 10− 3 6.0 10− 3 6.0 10− 3 1.0 10− 3 2.0 10− 3 3.0 10− 3 1.0 10− 3 2.0 10− 3 3.0 10− 3 6.0 10− 3 6.0 10− 3 6.0 10− 3 4.3 10− 例:复杂反应的动力学方程的确定

区化学反应速率和限度分析形成N,起始速率c(NO) (mol L')c(H2)/(mol · L-')D /(mol L- .s-")3.19×10-36.0x10-31.0×10-316.36×10-36.0×10-32.0×10-329.56×10-33.0×10-33 6.0×10-3讨论:C(NO)不变时:C(H2)增大两倍,速率增大两倍C(H2)增大三倍,速率增大三倍表明:反应速率与C(H)浓度的一次幂成正比即 vα[c(H2)]
化学反应速率和限度 (H )/(mol L ) 1 2 − (NO)/(mol L ) c -1 c 3 3.19 10− 3 6.36 10− 3 9.56 10− 3 6.0 10− 3 6.0 10− 3 6.0 10− 3 1.0 10− 3 2.0 10− 3 3.0 10− 1 2 3 讨论: C(NO) 不变时: C(H2 )增大两倍,速率增大两倍 C(H2 )增大三倍,速率增大三倍 分析 表明:反应速率与C(H2 )浓度的一次幂成正比。 /(mol L s ) 1 1 2 − − 形成N 起始速率 即 v∝[c(H2 )]

区化学反应速率和限度分析形成N,起始速率c(NO)(mol · L')c(H2)/(mol · L-')v /(mol - L-1 .s-')1.0 ×10-30.48×10-36.0×10-312.0×10-36.0×10-31.92 ×10-3234.3×10-33.0×10-36.0×10-3讨论: C(H2)不变时:0.48 ×2? =1.92C(NO)增大两倍,速率增大四倍0.48 X 32 =4.32C(NO)增大三倍,速率增大九倍表明:反应速率与C(NO)浓度的二次幂成正比。即 vα[c(NO)]2
化学反应速率和限度 (H )/(mol L ) 1 2 − (NO)/(mol L ) c -1 c 1 2 3 讨论: C(H2 ) 不变时: C(NO)增大两倍,速率增大四倍 C(NO)增大三倍,速率增大九倍 分析 3 0.48 10− 3 1.92 10− 3 1.0 10− 3 2.0 10− 3 3.0 10− 3 6.0 10− 3 6.0 10− 3 6.0 10− 3 4.3 10− /(mol L s ) 1 1 2 − − 形成N 起始速率 0.48×2 =1.92 0.48×3 =4.32 2 2 表明:反应速率与C(NO)浓度的二次幂成正比。 即 v∝[c(NO)]2

区化学反应速率和限度<称为反应速率常数,可用来表征反应的速率。k与温度、1催化剂有关,而与浓度无关对于n级反应其单位是(mol·dm-3)(n-1)s-1反应级数的意义,1表示了反应速率与物质的量浓度的关系:②零级反应表示了反应速率与反应物浓度无关
化学反应速率和限度 k与温度、催化剂有关,而与浓度无关对 于n级反应其单位是(moldm-3 ) (n-1)s -1 k 称为反应速率常数, 可用来表征 反应的速率。 反应级数的意义: ① 表示了反应速率与物质的量浓度的关系; ②零级反应表示了反应速率与反应物浓度无关

区化学反应速率和限度速率常数的单位k的量纲为mol·dm-3.s-1零级反应: U=k(cA)°k的量纲为s-1一级反应:U=kcA;k的量纲为mol3.dm-1.s-1二级反应:u =k(cA)2气体反应可用气体分压表示2NO22NO + O2;V=k.C(No,);或2; kc±kpv=k.PI (NO2)
化学反应速率和限度 速率常数的单位 零级反应: = k(cA) 0 k的量纲为mol·dm-3·s-1 一级反应: = kcA; k的量纲为s -1 二级反应: = k(cA) 2 k的量纲为mol3·dm-1·s-1 气体反应 可用气体分压表示 2NO2 → 2NO + O2; ; 或 ; kc kP 2 v = kc c(NO2 ) 2 v = k p P(NO2 )