
(3)无膜金属与酸的反应 Cr+2H(稀)→Cr2+(蓝)+H,个 0 2 Cr+(紫) 2Cr+2H2S0,(浓)→Cr,(S043+3SO2个+H20 在冷、浓硝酸中钝化 2.铬(Ⅲ)的化合物 (1)Cr,O,(铬绿)—两性氧化物 制备:4Cr+302△→2Cr,0 NH4)2Cr,0,4→C,O3+N2个+4H20 性质:Cr,0,+6H4→Cr3++3H,0 3H,0+Cr,03+20H→2C(OH4
在冷、浓硝酸中钝化 (3)无膜金属与酸的反应 Cr ( ) 2 3+ 紫 O 2Cr + 2H2 SO4 (浓) → Cr(2 SO4 )3 + 3SO2 +H2 O + → + + + 2 2 Cr 2H (稀) Cr (蓝) H 2. 铬(Ⅲ)的化合物 (1)Cr2 O(铬绿) 3 制备: 性质: 2 3 Δ 4Cr + 3O2 ⎯→2Cr O Cr O 6H Cr 3H2 O 3 2 3 + ⎯→ + + + (NH ) Cr O Cr2 O3 N2 4H2 O Δ 4 2 2 7 ⎯→ + + − → − 3H2 O + Cr2 O3 + 2OH 2Cr(OH)4 ——两性氧化物
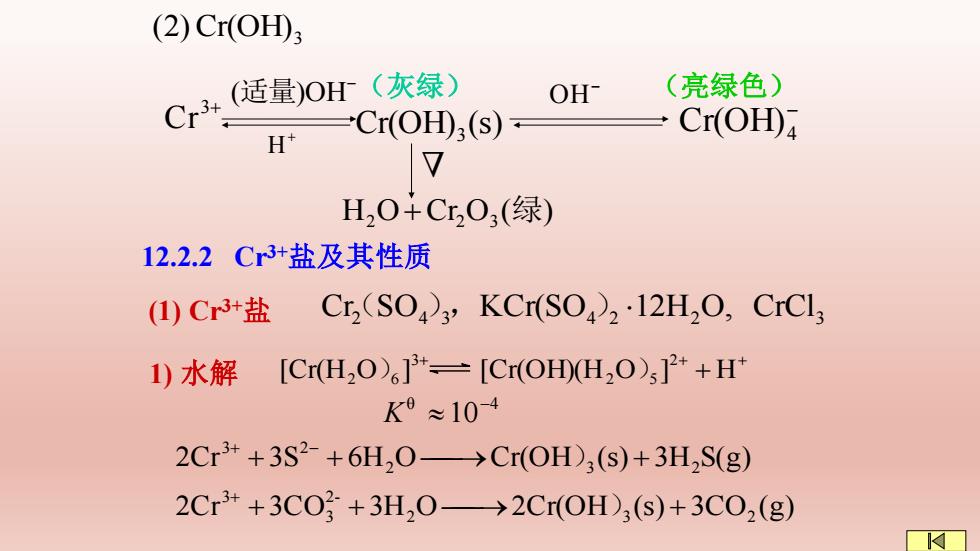
(2)Cr(OH) Cr+(适量)0r(灰绿) OH (亮绿色) Cr(OH)(s) Cr(OH) H H0+Cr,O3(绿) 12.2.2Cr3+盐及其性质 (1)Cr3+盐 Cr,(SO3,KCr(SO212H2O,CrCls 1)水解 [Cr(H2O)6]3+=[Cr(OH0H,O)]2++H K8≈10-4 2Cr3++3S2-+6H,0→Cr(OH)3(S)+3H2S(g) 2Cr3++3CO3+3H20→2Cr(OH),s)+3C0,(g)
Cr(OH)3 (2) 3+ Cr Cr(OH) (s) 3 − (适量)OH + H (灰绿) (亮绿色) H O Cr O ( ) 2 + 2 3 绿 Δ − OH − Cr(OH)4 12.2.2 Cr3+盐及其性质 2 4 3 4 2 2 CrCl3 Cr(SO ),KCr(SO )12H O, θ 4 10− K 2Cr 3S 6H O Cr(OH (s) 3H S(g) 2 3 2 3 2 + + ⎯→ + + − ) 2Cr 3CO 3H O 2Cr(OH (s) 3CO (g) 2 3 2 2- 3 3 + + ⎯→ + + ) + + + [Cr(H O ] [Cr(OH)(H O ] + H 2 2 5 3 2 )6 ) (1) Cr3+盐 1) 水解

2)还原性 酸性条件:E(Cr,O号/Cr3+)=1.33V 2Cr3++3S,0%+7H,0Ag→C,0号+S0}+14H 碱性条件:E(CO4/Cr(OH)4)=-0.12V 2Cr(OH)+3H,O2 +20H->CrO+8H2O 3)氧化性 Cr3++Zn(S)→2Cr2+(蓝色)+Zn2+ 12.2.3Cr3+的配合物 C3+的配合物有数千种,绝大多数配位数:6 常见的是:[C(H2O)6]3+,配合物多有颜色 [Cr(HO)6]Cl2紫色 [Cr(H2O),CI]CL2·H,O蓝绿色 [Cr(H2O),CL2]1C1·2H,O绿色
2)还原性 (Cr O /Cr ) 1.33V 2 3 2 7 θ = − + 酸性条件:E + + + + → + 3 2 2 Cr Zn(s) 2Cr (蓝色) Zn [Cr(H2 O)6 ]Cl2 紫色 2Cr(OH) 3H O 2OH CrO 8H2 O 2 4 + 2 2 + → 4 + − − − (CrO /Cr(OH) ) 0.12V - 4 4 θ = − − 碱性条件:E + − − − + + + ⎯⎯→ + + + 2Cr 3S O 7H O Cr O SO 14H 2 4 2 2 7 Ag 2 2 2 8 3 12.2.3 Cr3+的配合物 Cr3+的配合物有数千种,绝大多数配位数:6 常见的是:[Cr(H2O)6 ] 3+ , 配合物多有颜色 [Cr(H2 O)4 Cl2 ]Cl2H2 O绿色 [Cr(H2 O)5 Cl]Cl2 H2 O蓝绿色 3)氧化性

12.2.4铬(1)盐 1.Cr20,2-与Cr042-间的转化 ①pH值的影响 2CrO+2H*-2HCrO-Cr,O+H,O (黄) (橙) pH<2:CO,2为主 pH>6:CrO42为主 ②溶解度的影响 K(Ag2Cr,0,)=2.0x10-7 Kp(Ag2Cr04)=1.1x10-2 4Ag+CO号+H20→2Ag2CrO,(s,砖红)+2H 2Ba2++Cr,O号+H,O—→2 BaCrO,(s,柠檬黄)+2H 2Pb2++Cr,O号+H20—→2 PbCrO4(s,黄)+2H
1. Cr2O7 2-与CrO4 2-间的转化 pH值的影响 pH<2:Cr2O7 2-为主 pH>6:CrO4 2-为主 (黄) (橙) 溶解度的影响 (Ag CrO ) 1.1 10 12 2 4 θ sp − K = + − + 2Pb + Cr O + H2 O ⎯→2PbCrO4 (s, ) + 2H 2 2 7 2 黄 + − + 2Ba + Cr O + H2 O ⎯→2BaCrO4 (s, ) + 2H 2 2 7 2 柠檬黄 + − + 4Ag + Cr O + H2 O ⎯→2Ag2 CrO4 (s, ) + 2H 2 2 7 砖红7 2 2 7 θ sp (Ag Cr O ) 2.0 10− K = 12.2.4 铬(Ⅵ)盐 2CrO 2H 2HCrO Cr O H2 O 2 4 2 7 2 4 + + − + − −

2.Cr2022-的氧化性 E(Cr,O号/Cr3+)=1.33V C,0号+3S0}+8Ht→3S02+2Cr3++4H,0 CL,O号+3H,S+8H+→3S+2Cr3++7H,0 Cr0号+6I+14H→3L2+2Cr3+7H20 Cr,0号+6Fe2++14H+→6Fe3++2Cr3++7H,0 Cr,02+3Sn2++14Ht→3Sn4++2Cr3++7H,0 K,C,0,(S)+14HC(浓)→3CL2个+2CrC13+2KC1+7H20 K2Cr20,及其溶液非常稳定,可作为基准物测定其它物质 实验室常用洗液:KCrO+浓HSO4 K2CO2+H2S04(浓)→K2S04+2CrO3(S)+H2O
2. Cr2O7 2-的氧化性 (Cr O /Cr ) 1.33V 2 3 2 7 θ = − + E Cr O 3Sn 14H 3Sn 2Cr 7H2 O 2 2 4 3 2 7 + + ⎯→ + + − + + + + Cr O 6Fe 14H 6Fe 2Cr 7H2 O 2 2 3 3 2 7 + + ⎯→ + + − + + + + K2 Cr2 O7 (s) +14HCl(浓) ⎯→3Cl2 +2CrCl3 + 2KCl+ 7H2 O Cr O 6I 14H 3I 2Cr 7H2 O 3 2 2 2 7 + + ⎯→ + + − − + + Cr O 3H S 8H 3S 2Cr 7H2 O 3 2 2 2 7 + + ⎯→ + + − + + Cr O 3SO 8H 3SO 2Cr 4H2 O 2 3 4 2 3 2 2 7 + + ⎯→ + + − − + − + K2Cr2O7及其溶液非常稳定,可作为基准物测定其它物质 实验室常用洗液: K2Cr2O7+浓H2SO4 K2 Cr2 O7 + H2 SO4 (浓) ⎯→K2 SO4 + 2CrO3 (s) + H2 O