
类似的,定义 离子平均活度系数(mean activity coefficient of ions) def( 离子平均质量摩尔浓度(mean molality of ions) m4dcf(mm)% 易推导得到如下结果: =aa心=ag=(0y:%》
类似的,定义 1 def ( ) + − + − 离子平均活度系数(mean activity coefficient of ions) 1 def m m m ( ) + − + − 离子平均质量摩尔浓度(mean molality of ions) o m a m = ( ) o m m = B a a a a + − + − = = 易推导得到如下结果:

例:写出CuS04,K2SO4与A2S04)3离子平均浓度与 电解质浓度的关系 CuSO mce =m,mso=m,V.=v =1,v=V,+v=2 m:=(m·m)=m NaSO,:myo =2m,msor=m,v,=2,v.=1,v=V+v=3 m=(mmt)=[(2m'm]=4.m 4,(S04)3:mo=2m,mo2=3m,V,=2,.=3,v=+业.=5 %=(mm)=[(2m-(3m)]=108.m
例:写出CuSO4,K2SO4与Al2 (SO4 )3离子平均浓度与 电解质浓度的关系 ( ) 2 2 4 4 + + 1 / : , , 1, 2 Cu SO CuSO m m m m m m m m + − + − + − − − = = = = = + = = = ( ) ( ) 2 4 2 4 + + 1 / 1/3 2 1/3 : 2 , , 2, 1, 3 2 4 Na SO Na SO m m m m m m m m m m + − + − + − − − = = = = = + = = = = ( ) ( ) ( ) ( ) 2 4 2 4 + + 3 1 / 1/5 2 3 1/5 : 2 , 3 , 2, 3, 5 2 3 108 Na SO Al SO m m m m m m m m m m + − + − + − − − = = = = = + = = = =

计算m=1.20 mol kg1的MgCL2水溶液在298K时的电解质活 度已知Y=0.630. 解:先求平均浓度与电解质浓度的关系 mus=m,mcr =2m,V.=1,v=2,v=v,+v=3 m=(m)=[m-(2m)2]=43.m a±=y±·m4/m°=0.630×43×1.20=1.20 aB=a=1.203=1.73
解:先求平均浓度与电解质浓度的关系 ( ) ( ) 2 + + 1 / 1/3 2 1/3 1/3 3 , 2 , 1, 2, 3 2 4 / 0.630 4 1.20 1.20 1.20 1.73 Mg Cl o B m m m m m m m m m m a m m a a + − + − + − − − = = = = = + = = = = = = = = = = 计算 m=1.20 mol kg-1的MgCl2水溶液在298K时的电解质活 度已知 0.630 . =
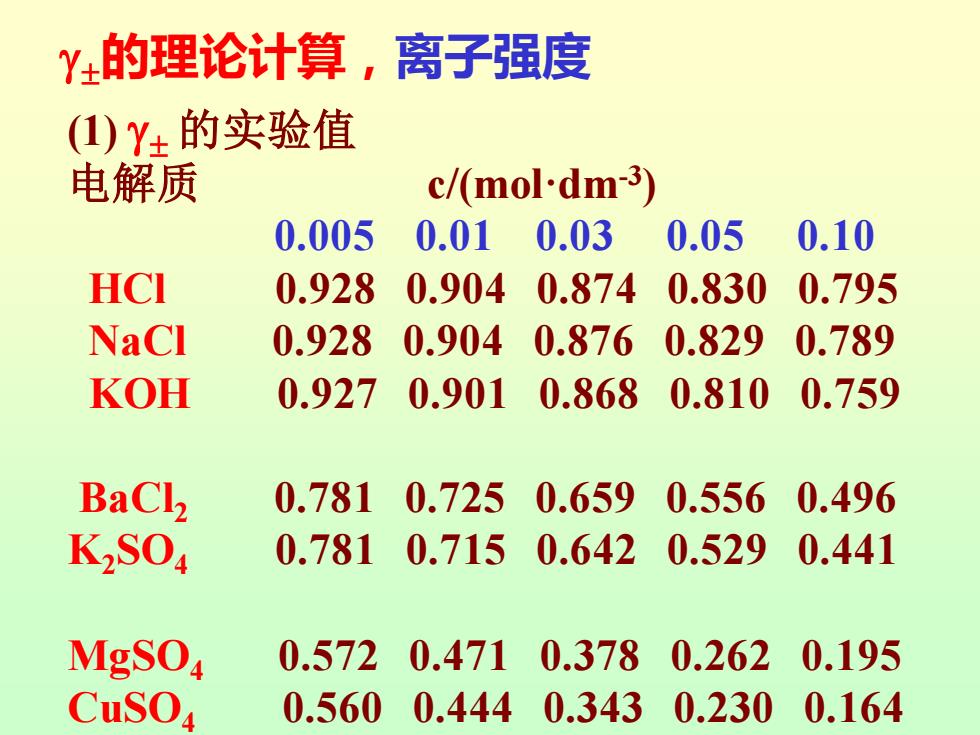
Y±的理论计算,离子强度 (1)Y±的实验值 电解质 c/(mol-dm-3) 0.005 0.01 0.03 0.05 0.10 HCI 0.928 0.9040.874 0.830 0.795 NaCl 0.928 0.904 0.876 0.829 0.789 KOH 0.927 0.9010.8680.810 0.759 BaCl2 0.7810.725 0.6590.556 0.496 K2S04 0.7810.7150.6420.5290.441 MgSO 0.572 0.4710.378 0.262 0.195 CuSO 0.5600.444 0.3430.2300.164
(1) 的实验值 电解质 c/(mol·dm-3 ) 0.005 0.01 0.03 0.05 0.10 HCl 0.928 0.904 0.874 0.830 0.795 NaCl 0.928 0.904 0.876 0.829 0.789 KOH 0.927 0.901 0.868 0.810 0.759 BaCl2 0.781 0.725 0.659 0.556 0.496 K2SO4 0.781 0.715 0.642 0.529 0.441 MgSO4 0.572 0.471 0.378 0.262 0.195 CuSO4 0.560 0.444 0.343 0.230 0.164 的理论计算,离子强度

离子强度 从实验结果看出,影响离子平均活度系数的主 要因素是电解质的总浓度和离子的价数,而价数的 影响更显著。 据此Lewis和Randall提出了离子强度(ionic strength)的概念。溶液的离子强度定义为离子浓 度与其价数的平方乘积总和的一半,写作 1=2∑mz 式中是溶液中离子的真实质量摩尔浓度,如果是 弱电解质则应由其相应的电离度求得;z是离子的价 数。离子强度的量纲与m相同
离子强度 2 i i i 1 2 I m z = 式中mi是溶液中i离子的真实质量摩尔浓度,如果是 弱电解质则应由其相应的电离度求得;zi是离子的价 数。离子强度I的量纲与m相同。 从实验结果看出,影响离子平均活度系数的主 要因素是电解质的总浓度和离子的价数,而价数的 影响更显著。 据此Lewis和Randall提出了离子强度(ionic strength)的概念。溶液的离子强度I定义为离子浓 度与其价数的平方乘积总和的一半,写作 I